Aktif maddeler: Esomeprazol
Nexium Control 20 mg mideye dayanıklı tabletler
Endikasyonlar Nexium Control neden kullanılır? Bu ne için?
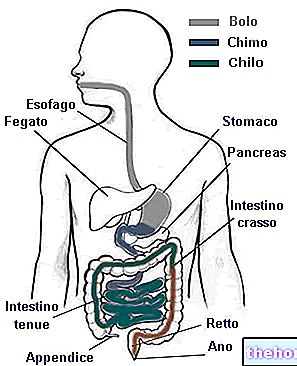
Nexium Control, aktif madde esomeprazol içerir. "Proton pompa inhibitörleri" adı verilen bir ilaç grubuna aittir. Bunlar mide tarafından üretilen asit miktarını azaltarak çalışır.
Bu ilaç yetişkinlerde reflü semptomlarının (örneğin mide ekşimesi ve asit yetersizliği) kısa süreli tedavisinde kullanılır.
Reflü, asidin mideden yemek borusuna ("gıda kanalı") geri akmasıdır, bu da iltihaplı ve ağrılı hale gelebilir. Bu, göğüste boğaza kadar yükselen ağrılı bir his (mide ekşimesi) ve ağızda ekşi bir tat (asit yetersizliği) gibi semptomlara neden olabilir.
Nexium Control, anında rahatlama sağlamak için tasarlanmamıştır. Kendinizi daha iyi hissetmeden önce tabletleri 2-3 gün üst üste almanız gerekebilir. 14 gün sonra kendinizi daha iyi hissetmiyorsanız veya daha kötü hissediyorsanız doktorunuzla konuşun.
Kontrendikasyonlar Nexium Control kullanılmamalıdır
Nexium Control almayın
- Esomeprazol veya bu ilacın içerdiği diğer maddelerden herhangi birine karşı alerjiniz varsa
- Diğer proton pompası inhibitörlerini (örn. pantoprazol, lansoprazol, rabeprazol veya omeprazol) içeren ilaçlara alerjiniz varsa.
- Nelfinavir içeren bir ilaç alıyorsanız (HIV enfeksiyonlarını tedavi etmek için kullanılır)
Yukarıdaki durumlardan herhangi birine denk gelirse bu ilacı almamalısınız. Şüpheniz varsa, bu ilacı almadan önce doktorunuza veya eczacınıza danışınız.
Kullanım Önlemleri Nexium Control'ü kullanmadan önce bilmeniz gerekenler
Aşağıdaki durumlarda Nexium Control almadan önce doktorunuzla konuşun:
- Geçmişte "mide ülseri veya mide ameliyatı geçirdiniz".
- Reflü veya mide ekşimesi için 4 veya daha fazla hafta boyunca sürekli tedavi gördünüz.
- Sarılık (cildin ve gözlerin sararması) veya ciddi karaciğer problemleriniz var.
- Ciddi böbrek problemleriniz var.
- 55 yaşın üzerindedir ve yeni veya yakın zamanda değiştirilmiş reflü semptomları olmuştur veya reçetesiz olarak her gün hazımsızlık veya mide ekşimesi tedavisine ihtiyaç duymaktadır.
- Bu ilacı almadan önce veya aldıktan sonra, başka, daha ciddi bir hastalığın belirtileri olabilecek aşağıdaki belirtilerden herhangi birini fark ederseniz hemen doktorunuzla konuşun.
- sebepsiz yere çok kilo verir.
- Yutmada zorluk veya ağrınız var.
- Mide ağrısı veya mide bulantısı, dolgunluk, şişkinlik gibi hazımsızlık belirtileri, özellikle yemeklerden sonra ortaya çıkar.
- Kusmuğunda kahve telvesi kadar koyu görünen yiyecek veya kan kusmaya başlar.
- Dışkı siyahtır (kanlı dışkı).
- Şiddetli veya kalıcı ishal var esomeprazol, bulaşıcı diyare riskinde küçük bir artış ile ilişkilendirilmiştir.
Baş dönmesi, terleme, baş dönmesi veya omuz ağrısı ve nefes darlığı ile birlikte göğüs ağrısı hissediyorsanız, doktorunuzdan acil tavsiye alın. Bu ciddi bir kalp probleminin belirtisi olabilir.
Aşağıdaki durumlarda bu ilacı almadan önce doktorunuzu arayın:
- Endoskopi veya üre nefes testinden geçmelisiniz.
- Belirli bir kan testi yaptırmanız gerekir (Chromogranin A)
Yukarıdakilerden herhangi biri sizin için geçerliyse (veya emin değilseniz), lütfen hemen doktorunuzla iletişime geçin.
Çocuklar ve ergenler
Bu ilaç çocuklarda ve 18 yaşın altındaki ergenlerde kullanılmamalıdır.
Etkileşimler Hangi ilaçlar veya yiyecekler Nexium Control'ün etkisini değiştirebilir
Başka ilaçlar alıyorsanız, yakın zamanda aldıysanız veya alma ihtimaliniz varsa doktorunuza veya eczacınıza söyleyiniz.Bunun nedeni, bu ilacın bazı ilaçların çalışma şeklini etkileyebilmesi ve bazı ilaçların da etki edebilmesidir.
Nelfinavir (HIV enfeksiyonunu tedavi etmek için kullanılır) içeren bir ilaç da alıyorsanız bu ilacı almamalısınız.
Klopidogrel (kan pıhtılarını önlemek için kullanılır) alıyorsanız bunu özellikle doktorunuza veya eczacınıza söylemelisiniz.
Bu ilacı, proton pompa inhibitörleri (örn. pantoprazol, lansoprazol, rabeprazol veya omeprazol) veya H2 antagonistleri (örn. ranitidin veya famotidin) gibi midede üretilen asit miktarını sınırlayan diğer ilaçlarla birlikte almamalısınız.
Gerekirse bu ilacı antasitler (örn. magaldrat, alginik asit, sodyum bikarbonat, alüminyum hidroksit, magnezyum karbonat veya bunların kombinasyonları) ile birlikte alabilirsiniz.
Aşağıdaki ilaçlardan herhangi birini alıyorsanız doktorunuza veya eczacınıza söyleyiniz:
- Ketokonazol ve itrakonazol (bir mantarın neden olduğu enfeksiyonları tedavi etmek için kullanılır)
- Vorikonazol (bir mantarın neden olduğu enfeksiyonları tedavi etmek için kullanılır) ve klaritromisin (enfeksiyonları tedavi etmek için kullanılır). Ayrıca ciddi karaciğer problemleriniz varsa ve uzun süredir tedavi görüyorsanız, doktorunuz Nexium Control dozunu ayarlayabilir.
- Erlotinib (kanser tedavisi için kullanılır)
- Metotreksat (kanser ve romatizmal hastalıkların tedavisinde kullanılır)
- Digoksin (kalp sorunları için kullanılır)
- Atazanavir, sakinavir (HIV enfeksiyonunu tedavi etmek için kullanılır)
- Sitalopram, imipramin veya klomipramin (depresyon tedavisinde kullanılır)
- Diazepam (anksiyete tedavisinde, kas gevşemesinde veya epilepside kullanılır)
- Fenitoin (epilepsi tedavisinde kullanılır)
- Varfarin gibi kanı inceltmek için kullanılan ilaçlar. Nexium Control ile tedaviyi başlatırken veya durdururken doktorunuzun sizi izlemesi gerekebilir.
- Silostazol (aralıklı topallamayı tedavi etmek için kullanılır - bacak kaslarına yetersiz kan akışının ağrıya ve yürüme zorluğuna neden olduğu bir durum)
- Sisaprid (hazımsızlık ve mide ekşimesi için kullanılır)
- Rifampisin (tüberküloz tedavisinde kullanılır)
- Takrolimus (organ nakli durumunda)
- Sarı kantaron (Hypericum perforatum) (depresyon tedavisinde kullanılır)
Uyarılar Şunları bilmek önemlidir:
Hamilelik ve emzirme
Önlem olarak, tercihen hamilelik sırasında Nexium Control kullanımından kaçınmalısınız.Bu ilacı emzirme döneminde kullanmamalısınız.
Hamileyseniz veya emziriyorsanız, hamile olabileceğinizi düşünüyorsanız veya bebek sahibi olmayı planlıyorsanız, bu ilacı almadan önce doktorunuza veya eczacınıza danışınız.
Araç ve makine kullanma
Nexium Control'ün araç veya makine kullanma yeteneğini etkileme olasılığı düşüktür. Ancak, baş dönmesi ve görme bozuklukları gibi yan etkiler yaygın değildir (bkz. Bölüm 4). Görünürlerse, araç veya makine kullanmamalısınız.
Nexium Control sakaroz içerir
Nexium Control, bir şeker türü olan sakaroz içeren şeker küreleri içerir. Doktorunuz tarafından "bazı şekerlere karşı intoleransınız" olduğu söylenmişse, ilacı almadan önce doktorunuza danışınız.
Doz, Uygulama Yöntemi ve Zamanı Nexium Control nasıl kullanılır: Pozoloji
Bu ilacı her zaman tam olarak bu kullanma talimatında belirtildiği şekilde veya doktorunuz veya eczacınız tarafından belirtildiği şekilde alınız. Şüpheniz varsa, doktorunuza veya eczacınıza danışın.
ne kadar alınır
- Önerilen doz günde bir tablettir.
- Anında iyileşme hissetmeseniz bile, günde bir tablet (20 mg) olarak önerilen bu dozdan fazlasını almayın.
- Tabletleri reflü semptomlarınız (örneğin mide ekşimesi ve asit yetersizliği) düzelmeden önce iki ila üç gün üst üste almanız gerekebilir.
- Tedavi süresi 14 güne kadardır.
- Reflü semptomları tamamen ortadan kalktığında bu ilacı almayı bırakmalısınız.
- Bu ilacı 14 gün üst üste aldıktan sonra reflü semptomlarınız kötüleşir veya düzelmezse doktorunuza danışmalısınız.
Bu ilaçla tedavinizden sonra bile, sıklıkla kalıcı veya uzun süreli yinelenen semptomlarınız varsa, lütfen doktorunuzla iletişime geçin.
ilacı almak
- Tableti günün herhangi bir saatinde yemekle birlikte veya aç karnına alabilirsiniz.
- Tableti bütün olarak bir bardak su ile yutunuz. Tableti çiğnemeyin veya ezmeyin. Bunun nedeni, tabletin ilacı mide asidinden koruyan kaplanmış granüller içermesidir, bu nedenle granüllere zarar vermemek önemlidir.
İlaç almanın alternatif yöntemi
- Tableti bir bardak durgun (karbonatsız) suya koyun. Başka sıvı kullanmayın.
- Tablet eriyene kadar karıştırın (karışım berrak olmayacaktır), ardından karışımı hemen veya 30 dakika içinde için. Karışımı her zaman içmeden hemen önce karıştırın.
- İlacın tamamını içtiğinizden emin olmak için bardağı yarım bardak su ile iyice çalkalayın ve için. Katı parçacıklar ilacı içerir - çiğnemeyin veya ezmeyin.
Aşırı doz Çok fazla Nexium Control aldıysanız ne yapmalısınız?
Kullanmanız gerekenden daha fazla Nexium Control kullandıysanız
Tavsiye edilenden daha fazla Nexium Control aldıysanız, derhal doktorunuza veya eczacınıza söyleyiniz. İshal, mide ağrısı, kabızlık, hasta ve yorgun hissetme veya hissetme gibi belirtiler ortaya çıkabilir.
Nexium Control'ü kullanmayı unutursanız
Bir doz almayı unutursanız, aynı gün hatırlar hatırlamaz alınız. Unutulan bir dozu telafi etmek için çift doz almayınız. Bu ilacın kullanımıyla ilgili başka sorularınız varsa, doktorunuza veya eczacınıza sorunuz.
Yan Etkiler Nexium Control'ün yan etkileri nelerdir?
Tüm ilaçlar gibi, bu ilaç da yan etkilere neden olabilir, ancak bunları herkes almayabilir.
Aşağıdaki ciddi yan etkilerden herhangi birini fark ederseniz, Nexium Control almayı bırakın ve hemen doktorunuzla iletişime geçin:
- Ani hırıltı, dudaklarda, dilde ve boğazda şişme, döküntü, bayılma veya yutma güçlüğü (nadir görülen şiddetli alerjik reaksiyon).
- Kabarcıklar veya soyulma ile cilt kızarıklığı. Dudaklarda, gözlerde, ağızda, burunda ve cinsel organlarda da şiddetli kabarma ve kanama görülebilir. Bu çok nadir görülen "Stevens-Johnson sendromu" veya "toksik epidermal nekroliz" olabilir.
- Nadiren görülen karaciğer sorunlarının belirtileri olabilen sarı cilt, koyu renkli idrar ve yorgunluk.
Aşağıdaki enfeksiyon belirtilerinden herhangi birine sahipseniz, mümkün olan en kısa sürede doktorunuza görünün:
Bu ilaç, çok nadir durumlarda beyaz kan hücrelerini etkiler ve immün yetmezliğe yol açar. Genel sağlıkta ciddi bozulma ile seyreden ateş gibi semptomlarla veya boyun, boğaz veya ağızda ağrı veya idrar yapmada zorluk gibi lokal enfeksiyon semptomları ile ateş gibi belirtilerle seyreden bir enfeksiyon yaşarsanız, mümkün olan en kısa sürede doktorunuza başvurmalısınız. Beyaz kan hücrelerinin eksikliği (agranülositoz) bir kan testi yapılarak ekarte edilebilir; bu durumda, aldığınız ilacı doktorunuza söylemeniz önemlidir.
Diğer yan etkiler şunlardır:
Yaygın (10 kişiden 1'ini etkileyebilir)
- Baş ağrısı.
- Mide veya bağırsaklar üzerindeki etkiler: ishal, mide ağrısı, kabızlık, gaz (şişkinlik).
- Hasta hissetmek (bulantı) veya hasta olmak (kusma).
Yaygın olmayan (100 kişiden 1'ini etkileyebilir)
- Ayaklarda ve ayak bileklerinde şişme.
- Rahatsız uyku (uykusuzluk), uyku hali.
- Baş dönmesi, "iğne batması" gibi karıncalanma hissi.
- Dönme hissi (vertigo).
- Kuru ağız
- Karaciğerin nasıl çalıştığını kontrol eden kan testlerindeki değişiklikler.
- Deri döküntüsü, deride kabartılar (kurdeşen) ve kaşıntılı deri.
Seyrek (1.000 kişiden 1'ini etkiler)
- Az sayıda beyaz kan hücresi veya trombosit gibi kan sorunları. Bu, zayıflığa, morarmaya neden olabilir veya enfeksiyonları kolaylaştırabilir.
- Kandaki düşük sodyum seviyeleri. Bu halsizliğe, hastalanmaya (kusmaya) ve kramplara neden olabilir.
- Heyecanlı, kafası karışmış veya depresif hissetmek.
- Tat değişiklikleri.
- Bulanık görme gibi görme sorunları.
- Ani hırıltı veya nefes darlığı (bronkospazm).
- Ağız içinde iltihaplanma.
- Bağırsakları etkileyebilen ve bir mantarın neden olduğu "pamukçuk" adı verilen bir enfeksiyon.
- Saç dökülmesi (alopesi).
- Güneşe maruz kaldığında deri döküntüsü.
- Eklem ağrısı (artralji) veya kas ağrısı (miyalji).
- Genel olarak kendini iyi hissetmeme ve güçsüzlük hissi.
- Artan terleme.
Çok seyrek (10.000 kişiden 1'ini etkiler)
- Düşük sayıda kırmızı kan hücresi, beyaz kan hücresi ve trombosit (pansitopeni adı verilen bir durum).
- saldırganlık
- Orada olmayan şeyleri görme, hissetme veya duyma (halüsinasyonlar).
- Karaciğer yetmezliğine ve beyin iltihabına yol açan ciddi karaciğer sorunları. ? Kas Güçsüzlüğü.
- Şiddetli böbrek sorunları.
- Erkeklerde meme büyütme.
Bilinmiyor (mevcut verilerden sıklık tahmin edilemiyor)
- Kandaki düşük magnezyum seviyeleri. Bu yorgunluk, halsizlik (kusma), istemsiz kas kasılmaları, titreme ve kalp ritminde değişikliklere (aritmi) neden olabilir. Magnezyum seviyeniz çok düşükse, kanda düşük kalsiyum ve/veya potasyum seviyeleri de yaşayabilirsiniz.
- Bağırsak iltihabı (bu, ishale yol açabilir).
Yan etkilerin raporlanması
Herhangi bir yan etki yaşarsanız, doktorunuzla veya eczacınızla konuşun.Bu broşürde listelenmeyen olası yan etkiler de buna dahildir.
Yan etkileri doğrudan Ek V'te listelenen ulusal raporlama sistemi aracılığıyla da bildirebilirsiniz. Yan etkileri bildirerek bu ilacın güvenliği hakkında daha fazla bilgi sağlanmasına yardımcı olabilirsiniz.
Son Kullanma ve Saklama
Bu ilacı çocukların göremeyeceği ve erişemeyeceği bir yerde saklayın.
Bu ilacı kutu ve blister üzerinde belirtilen son kullanma tarihinden sonra EXP'den sonra kullanmayınız.Son kullanma tarihi o ayın son gününü ifade etmektedir.30°C'nin üzerinde saklamayınız.
Nemden korumak için bu ilacı orijinal ambalajında saklayınız.
Herhangi bir ilacı atık su veya evsel atık yoluyla atmayın.Artık kullanmadığınız ilaçları nasıl atacağınızı eczacınıza sorun.Bu çevrenin korunmasına yardımcı olacaktır.
Paket içeriği ve diğer bilgiler
Nexium Control'ün içeriği
- Aktif bileşen esomeprazoldür. Her tablet 20 mg esomeprazol (magnezyum trihidrat olarak) içerir.
- Diğer bileşenler şunlardır: gliserol monostearat 40-55, hiproloz, hipromelloz, demir oksit (kırmızı-kahverengi E 172), demir oksit (sarı E172), magnezyum stearat, metakrilik asit kopolimer etil akrilat (1: 1) %30'da dispersiyon, mikrokristalin selüloz, sentetik parafin, makrogol 6000, polisorbat 80, krospovidon (tip A), sodyum stearil fumarat, şeker küreleri (sakaroz), talk, titanyum dioksit (E 171) ve trietil sitrat.
Nexium Control'ün görünüşü ve paketin içeriği
Nexium Control mideye dayanıklı tabletler açık pembe, dikdörtgen, bikonvekstir ve bir tarafında "20 mg" ve diğer tarafında A / EH olarak işaretlenmiştir.
Nexium Control, 7 ve 14 mideye dayanıklı tablet içeren blister ambalajlarda mevcuttur.
Tüm paket boyutları pazarlanmayabilir.
Kaynak Paket Broşürü: AIFA (İtalyan İlaç Ajansı). Ocak 2016'da yayınlanan içerik. Mevcut bilgiler güncel olmayabilir.
En güncel sürüme erişmek için AIFA (İtalyan İlaç Ajansı) web sitesine erişmeniz önerilir. Sorumluluk reddi ve faydalı bilgiler.
01.0 TIBBİ ÜRÜNÜN ADI
NEXIUM CONTROL 20 MG GIDA DAYANIKLI TABLETLER
02.0 KALİTATİF VE KANTİTATİF BİLEŞİM
Her mideye dirençli tablet, 20 mg esomeprazol (magnezyum trihidrat olarak) içerir.
Bilinen etkiye sahip yardımcı madde(ler):
Her mideye dirençli tablet 28 mg sakaroz içerir.
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakın.
03.0 FARMASÖTİK FORM
Mide dayanıklı tablet.
Açık pembe, uzun, bikonveks, bir tarafta "20 mg" ve diğer tarafta A / EH işaretli film kaplı tablet.
04.0 KLİNİK BİLGİLER
04.1 Terapötik endikasyonlar
Nexium Control, yetişkinlerde reflü semptomlarının (örn. mide ekşimesi ve asit yetersizliği) kısa süreli tedavisi için endikedir.
04.2 Pozoloji ve uygulama yöntemi
Dozaj
Önerilen doz günde 20 mg esomeprazol (bir tablet)'dir.
Semptomları iyileştirmek için tabletleri 2-3 gün üst üste almak gerekebilir. Tedavi süresi 2 haftaya kadardır. Semptomlar tamamen ortadan kalktıktan sonra tedavi durdurulmalıdır.
Sürekli tedaviden sonraki 2 hafta içinde semptomların düzelmesi sağlanamazsa, hasta bir doktora danışmalıdır.
Özel popülasyonlar
Böbrek yetmezliği olan hastalar
Böbrek fonksiyon bozukluğu olan hastalarda doz ayarlaması gerekli değildir. Şiddetli böbrek yetmezliği olan hastalarda sınırlı deneyim göz önüne alındığında, bu tür hastalar dikkatle tedavi edilmelidir (bkz. bölüm 5.2).
Karaciğer yetmezliği olan hastalar
Hafif veya orta derecede karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Bununla birlikte, şiddetli karaciğer yetmezliği olan hastalar, Nexium Control almadan önce bir doktor tarafından bilgilendirilmelidir (bkz. bölüm 4.4 ve 5.2).
Yaşlı hastalar (≥65 yaş)
Yaşlı hastalarda doz ayarlaması gerekli değildir.
Pediatrik popülasyon
"reflü semptomlarının kısa süreli tedavisi (örn. mide ekşimesi ve asit regürjitasyonu)" endikasyonunda 18 yaşın altındaki pediyatrik popülasyonda NEXIUM Control'ün spesifik kullanımı için herhangi bir endikasyon yoktur.
Uygulama yöntemi
Tabletler yarım bardak su ile bütün olarak yutulmalıdır. Tabletler çiğnenmemeli veya ezilmemelidir.
Alternatif olarak, tablet yarım bardak durgun su içinde dağıtılabilir. Gastro-dirençli kaplama çözülebileceğinden diğer sıvılar kullanılmamalıdır. Su tablet dağılana kadar karıştırılmalı, granüllü sıvı hemen veya 30 dakika içinde içilmelidir.Bardak yarım bardak su ve içme suyu ile çalkalanmalıdır. Granüller çiğnenmemeli veya ezilmemelidir.
04.3 Kontrendikasyonlar
Esomeprazol, benzimidazol ikameleri veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık (bkz. bölüm 6.1).
Esomeprazol, nelfinavir ile birlikte kullanılmamalıdır (bkz. bölüm 4.5).
04.4 Özel uyarılar ve uygun kullanım önlemleri
Genel
Hastalara aşağıdaki durumlarda bir doktora danışmaları söylenmelidir:
• İstenmeyen önemli kilo kaybı, tekrarlayan kusma, disfaji, hematemez veya melena varsa ve mide ülseri şüphesi varsa veya mevcutsa, esomeprazol tedavisi semptomları hafifletip tanıyı geciktirebileceğinden ülserin malign doğası dışlanmalıdır.
• Daha önce "mide ülseri veya mide-bağırsak ameliyatı geçirmiş olmak.
• 4 hafta veya daha uzun süredir dispepsi veya mide ekşimesi semptomatik tedavisi görüyorsanız.
• Sarılık veya ağır karaciğer hastalığınız varsa.
• Yeni veya yakın zamanda değişen semptomları olan 55 yaşın üzerinde olanlar.
Uzun süreli tekrarlayan dispepsi veya mide ekşimesi semptomları olan hastalar, doktorlarını düzenli aralıklarla görmelidir. Özellikle 55 yaş üstü ve hazımsızlık ve mide ekşimesi için günlük reçetesiz tedavi gören hastalar doktor veya eczacılarına haber vermelidir.
Hastalar, Nexium Control'ü uzun süreli önleyici ilaç olarak almamalıdır.
Proton pompası inhibitörleri (PPI'ler) ile tedavi, aşağıdakilerden olanlar gibi gastrointestinal enfeksiyon riskinde hafif bir artışa neden olabilir.Salmonella Ve kampilobakter, ve muhtemelen ayrıca Clostridium difficile hastanede yatan hastalarda (bkz. bölüm 5.1).
Hastalar endoskopi veya üre nefes testi yapacaklarsa bu ilacı almadan önce doktorlarına danışmalıdırlar.
Diğer ilaçlarla kombinasyon
Esomeprazol ve atazanavirin birlikte uygulanması önerilmez (bkz. bölüm 4.5). Atazanavirin bir proton pompası inhibitörü ile kombinasyonunun kaçınılmaz olduğuna karar verilirse, atazanavir dozunun 100 mg ritonavir ile 400 mg'a yükseltilmesiyle birlikte yakın klinik izleme önerilir.20 mg esomeprazol dozu aşılmamalıdır.
Esomeprazol bir CYP2C19 inhibitörüdür Esomeprazol ile tedavinin başlangıcında veya sonunda, CYP2C19 tarafından metabolize edilen tıbbi ürünlerle potansiyel etkileşim düşünülmelidir. Klopidogrel ve esomeprazol arasında bir etkileşim gözlendi Bu etkileşimin klinik önemi belirsizdir Esomeprazolün klopidogrel ile kullanımı önerilmemelidir (bkz. bölüm 4.5).
Hastalar aynı anda başka bir PPI veya H2 antagonisti almamalıdır.
Sakaroz
Bu ilaç şeker küreleri (sakaroz) içerir. Nadir kalıtsal fruktoz intoleransı, glukoz-galaktoz malabsorpsiyonu veya sukraz-izomaltaz yetmezliği sorunları olan hastalar bu ilacı almamalıdır.
Laboratuvar testleri ile etkileşim
Artmış bir Kromogranin A (CgA) seviyesi, nöroendokrin tümörler için yapılan araştırmaları etkileyebilir. Bu etkileşimi önlemek için, esomeprazol tedavisi CgA tayininden beş gün önce geçici olarak kesilmelidir.
04.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim biçimleri
Etkileşim çalışmaları sadece yetişkinlerde yapılmıştır.
Esomeprazolün diğer tıbbi ürünlerin farmakokinetiği üzerindeki etkisi
Esomeprazol, omeprazolün bir enantiyomeri olduğundan, omeprazol ile gözlenen etkileşimlerin dikkate alınması tavsiye edilir.
Proteaz inhibitörleri
Omeprazol ve bazı proteaz inhibitörleri arasında etkileşimler bildirilmiştir. Bu etkileşimlerin klinik önemi ve mekanizmaları her zaman bilinmemektedir. Omeprazol tedavisi sırasında mide pH'ında bir artış, proteaz inhibitörlerinin absorpsiyonunu değiştirebilir.Diğer olası etkileşim mekanizmaları, CYP2C19'un inhibisyonu yoluyla meydana gelir.
Atazanavir ve nelfinavir için, omeprazol ile birlikte uygulandığında serum düzeylerinde azalma bildirilmiştir ve birlikte uygulanması önerilmemektedir. Sağlıklı gönüllülerde omeprazolün (günde bir kez 40 mg) 300 mg / ritonavir 100 mg ile birlikte uygulanması, atazanavir maruziyetinde önemli bir azalmaya neden olur (EAA, Cmaks ve Cmin'de yaklaşık %75 azalma). Atazanavir dozunun 400 mg'a yükseltilmesi, omeprazolün atazanavir maruziyeti üzerindeki etkisini telafi etmez. Günde iki kez omeprazol olmaksızın 300 mg / ritonavir 100 mg ritonavir ile gözlemlenen maruziyete kıyasla atazanavir maruziyetinde %30 azalma Omeprazolün (günde iki kez 40 mg) birlikte uygulanması nelfinavirin "EAA, ortalama Cmaks ve Cmin'i 36- azaltmıştır. Farmakolojik olarak aktif metabolit M8'in %39 ve "EAA, ortalama Cmaks ve Cmin'i %75-92 oranında azalmıştır. Omeprazol ve esomeprazolün farmakodinamik etkileri ve benzer farmakokinetik özellikleri nedeniyle, esomeprazol ve atazanavirin birlikte uygulanması önerilmez ve eşzamanlı uygulanması tavsiye edilmez. esomeprazol ve nelfinavir kontrendikedir (bkz. bölüm 4.3 ve 4.4).
Omeprazol (günde 40 mg) ile eşzamanlı tedavi sırasında sakinavirin (ritonavir ile birlikte uygulanan) serum düzeylerinde artış (%80-100) bildirilmiştir. Omeprazol 20 mg qd ile tedavinin, darunavir (ritonavir ile birlikte uygulanan) ve amprenavir (ritonavir ile birlikte uygulanan) maruziyeti üzerinde hiçbir etkisi olmamıştır.
Günde iki kez esomeprazol 20 mg ile tedavinin amprenavir maruziyeti üzerinde hiçbir etkisi olmamıştır (ritonavir ile birlikte uygulandığında veya birlikte uygulandığında).
metotreksat
Bazı hastalarda PPI ile birlikte verildiğinde metotreksat düzeylerinin arttığı bildirilmiştir. Yüksek doz metotreksat varlığında, esomeprazolün geçici olarak kesilmesinin düşünülmesi gerekebilir.
takrolimus
Esomeprazol ve takrolimusun birlikte uygulanmasıyla serum takrolimus seviyelerinde artış bildirilmiştir. Takrolimus konsantrasyonlarının yanı sıra böbrek fonksiyonunun (kreatinin klerensi) güçlendirilmiş izlemesi yapılmalı ve gerekirse takrolimus dozu ayarlanmalıdır.
pH'a bağlı absorpsiyonlu ilaçlar
Esomeprazol ve diğer ÜFE'ler ile tedavi sırasında mide asiditesinin baskılanması, pH'a bağlı mide emilimi olan ilaçların emilimini azaltabilir veya artırabilir.Esomeprazol tedavisi sırasında ketokonazol, itrakonazol ve erlotinib gibi tıbbi ürünlerin emilimi azalabilir ve esomeprazol tedavisi sırasında digoksin emilimi artabilir.
Sağlıklı deneklerde omeprazol (günde 20 mg) ve digoksin ile eşzamanlı tedavi, digoksinin biyoyararlanımını %10 oranında artırmıştır (on denekten ikisinde %30'a kadar). Digoksin toksisitesi nadiren bildirilmiştir. Ancak, yaşlı hastalara yüksek dozlarda esomeprazol uygulandığında dikkatli olunmalı ve bu nedenle digoksinin terapötik etkisinin izlenmesi güçlendirilmelidir.
CYP2C19 tarafından metabolize edilen tıbbi ürünler
Esomeprazol, başlıca esomeprazol metabolize edici enzim olan CYP2C19'u inhibe eder. Bu nedenle, esomeprazol, varfarin, fenitoin, sitalopram, imipramin, klomipramin, diazepam vb. gibi CYP2C19 yoluyla metabolize edilen diğer tıbbi ürünlerle kombine edildiğinde, bu tıbbi ürünlerin plazma konsantrasyonları artabilir ve doz azaltılması gerekebilir. CYP2C19 tarafından aktif metabolitine dönüştürülen bir ön ilaç olan klopidogrel durumunda, aktif metabolitin plazma konsantrasyonu azalabilir.
varfarin
Bir klinik çalışmada varfarin alan hastalara 40 mg esomeprazolün birlikte uygulanması, pıhtılaşma sürelerinin normal bir aralıkta kaldığını göstermiştir. Bununla birlikte, eş zamanlı tedavi sırasında pazarlama sonrası klinik açıdan anlamlı INR'nin arttığı bazı izole vakalar bildirilmiştir. Varfarin veya diğer kumarin türevleri ile tedavi sırasında esomeprazol ile eşzamanlı tedavinin başlangıcında ve sonlandırılmasında izleme önerilir.
klopidogrel
Sağlıklı gönüllülerde yapılan çalışmalardan elde edilen sonuçlar, klopidogrel (300 mg yükleme dozu / 75 mg günlük idame dozu) ile esomeprazol (günlük 40 mg oral) arasında farmakokinetik (PK) / farmakodinamik (PD) bir etkileşim olduğunu göstermiştir ve bu da ilacın aktif metabolitine maruz kalmanın azalmasına neden olmuştur. klopidogrel ortalama %40 olup, trombosit agregasyonunun (indüklenmiş ADP) maksimum inhibisyonunda ortalama %14'lük bir azalmaya neden olur.
Sağlıklı gönüllülerde yapılan bir çalışmada, sabit doz esomeprazol 20 mg + ASA 81 mg ve klopidogrel kombinasyonu uygulandığında, tek başına klopidogrel ile karşılaştırıldığında, klopidogrelin aktif metabolitine maruziyette yaklaşık %40'lık bir azalma gözlenmiştir. trombosit agregasyonunun (indüklenmiş ADP) maksimum inhibisyon seviyeleri her iki grupta da aynıydı.
Bu PK/PD etkileşiminin majör kardiyovasküler olaylar açısından klinik etkileri hakkında gözlemsel ve klinik çalışmalardan elde edilen benzersiz olmayan veriler rapor edilmiştir. Önlem olarak, esomeprazol ve klopidogrelin birlikte kullanımından kaçınılmalıdır.
fenitoin
40 mg esomeprazolün eşzamanlı uygulanması, epileptik hastalarda fenitoinin çukur plazma seviyelerinde %13'lük bir artışa neden olur. Esomeprazol ile tedaviye başlarken veya tedaviyi durdururken fenitoinin plazma konsantrasyonlarının izlenmesi önerilir.
vorikonazol
Omeoprazol (günde bir kez 40 mg), vorikonazolün (bir CYP2C19 substratı) Cmaks ve EAA'sını sırasıyla %15 ve %41 oranında artırmıştır.
silostazol
Omeoprazol ve esomeprazol, CYP2C19 inhibitörleri olarak işlev görür. Bir çapraz çalışmada sağlıklı gönüllülere 40 mg'lık dozlarda verilen omeprazol, silostazolün Cmaks ve EAA'sını sırasıyla %18 ve %26 ve aktif metabolitlerinden birinin sırasıyla %29 ve %69 oranında artırmıştır.
sisaprid
Sağlıklı gönüllülerde, 40 mg esomeprazolün birlikte uygulanması, plazma konsantrasyonu/zaman eğrisi (EAA) altındaki alanda %32'lik bir artışa ve eliminasyon yarı ömrünün (t1 / 2) %31 uzamasına neden oldu, ancak önemli bir artışa neden olmadı. sisapridin doruk plazma konsantrasyonlarında. Sisapridin tek başına uygulanmasından sonra gözlenen QTc aralığındaki hafif uzama, sisaprid esomeprazol ile birlikte uygulandığında daha fazla uzamaz.
diazepam
30 mg esomeprazolün birlikte uygulanması, CYP2C19 substratı diazepamın klerensinde %45'lik bir azalma ile sonuçlanmıştır.
İlgili klinik etkileşimler olmadan çalışılan tıbbi ürünler
Amoksisilin ve kinidin
Esomeprazolün, amoksisilin ve kinidin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisinin olmadığı gösterilmiştir.
Naproksen veya rofekoksib
Esomeprazolün naproksen veya rofekoksib ile birlikte uygulanmasını değerlendiren çalışmalar, kısa süreli çalışmalarda klinik olarak anlamlı farmakokinetik etkileşimler ortaya koymamıştır.
Diğer tıbbi ürünlerin esomeprazolün farmakokinetiği üzerindeki etkisi
CYP2C19 ve/veya CYP3A4'ü inhibe eden tıbbi ürünler
Esomeprazol, CYP2C19 ve CYP3A4 yoluyla metabolize edilir Esomeprazolün bir CYP3A4 inhibitörü olan klaritromisin (günde iki kez 500 mg (bid) ile birlikte tedavisi), esomeprazol maruziyetinin (EAA) iki katına çıkmasına neden olur. CYP2C19 ve CYP3A4, esomeprazolün iki katından fazla maruz kalmasına neden olabilir. CYP2C19 ve CYP3A4 inhibitörü olan vorikonazol, omeprazolün EAA'sını %280 artırır. Yukarıda belirtilen durumlardan herhangi birinde rutin olarak esomeprazol doz ayarlaması gerekli değildir. Ancak, şiddetli karaciğer yetmezliği olan hastalarda ve uzun süreli tedavi endike ise doz ayarlaması düşünülmelidir.
CYP2C19 ve/veya CYP3A4'ü indükleyen tıbbi ürünler
CYP2C19 veya CYP3A4 veya her ikisini indüklediği bilinen tıbbi ürünler (rifampisin ve sarı kantaron (Hypericum perforatum) gibi) esomeprazolün artan metabolizması nedeniyle esomeprazol serum düzeylerinin düşmesine neden olabilir.
04.6 Hamilelik ve emzirme
Gebelik
Gebe kadınlarla ilgili (300-1000 gebelik sonucu arasında) az miktarda veri, esomeprazolün malformasyonu veya fetüs/neonatal toksisitesi olmadığını gösterir.
Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesi ile ilgili olarak doğrudan veya dolaylı zararlı etkiler göstermemektedir (bkz. bölüm 5.3).
Önlem olarak, hamilelik sırasında Nexium Control kullanımından kaçınılması tercih edilir.
Besleme zamanı
Esomeprazolün/metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir.Esomeprazolün yenidoğan/bebek üzerindeki etkileri hakkında yeterli bilgi yoktur.Esomeprazol emzirme döneminde kullanılmamalıdır.
Doğurganlık
Omeprazolün rasemik karışımı ile ağızdan uygulanan hayvan çalışmaları doğurganlık üzerinde hiçbir etki göstermemiştir.
04.7 Araç ve makine kullanma yeteneği üzerindeki etkiler
Esomeprazolün araç veya makine kullanma yeteneği üzerinde minör etkileri vardır. Baş dönmesi ve görme bozuklukları gibi advers reaksiyonlar yaygın değildir (bkz. bölüm 4.8). Bu semptomların varlığında hastalar araç veya makine kullanmamalıdır.
04.8 İstenmeyen etkiler
Güvenlik profilinin özeti
Baş ağrısı, karın ağrısı, ishal ve mide bulantısı klinik çalışmalarda (ve ayrıca pazarlama sonrası kullanımdan kaynaklanan) en sık bildirilen advers reaksiyonlar arasındadır.Ayrıca, farklı formülasyonlar, tedavi endikasyonları, gruplar için güvenlik profili benzerdir Yaş ve hasta popülasyonu Hayır Doza bağlı advers reaksiyonlar belirlendi.
Advers reaksiyon tablosu
Esomeprazol ile yapılan klinik çalışmalar sırasında ve pazarlama sonrası aşağıdaki advers reaksiyonlar tespit edilmiştir veya bundan şüphelenilmiştir. Reaksiyonlar, sıklık konusundaki MedDRA sözleşmesine göre sınıflandırılmıştır: çok yaygın> 1/10; ortak ≥1 / 100,
Şüpheli advers reaksiyonların raporlanması
Tıbbi ürünün yarar/risk oranının sürekli olarak izlenmesine olanak sağladığından, tıbbi ürünün ruhsatlandırılmasından sonra meydana gelen şüpheli advers reaksiyonların raporlanması önemlidir.Sağlık profesyonellerinden herhangi bir şüpheli advers reaksiyonu İtalyan İlaç Ajansı'na bildirmeleri istenir. : https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
04.9 Doz aşımı
Kasıtlı doz aşımı konusunda şu anda "çok sınırlı" deneyim mevcuttur. 280 mg alımıyla bağlantılı olarak açıklanan semptomlar gastrointestinal semptomlar ve zayıflıktı 80 mg'lık tek doz esomeprazol herhangi bir sonuca neden olmadı Spesifik bir antidot bilinmiyor Esomeprazol büyük ölçüde plazma proteinlerine bağlanır ve bu nedenle hızlı diyalize edilemez. Tedavi semptomatik olmalı ve genellikle destekleyici önlemler kullanılmalıdır.
05.0 FARMAKOLOJİK ÖZELLİKLER
05.1 Farmakodinamik özellikler
Farmakoterapötik grup: asitle ilgili bozukluklar için ilaçlar, asit pompası inhibitörleri, ATC kodu: A02BC05.
Esomeprazol, omeprazolün S izomeridir ve hedeflenen spesifik bir etki mekanizması ile gastrik asit sekresyonunu azaltır Esomeprazol, parietal hücredeki asit pompasının spesifik bir inhibitörüdür. Omeprazolün hem R hem de S izomerleri benzer farmakodinamik aktiviteye sahiptir.
Hareket mekanizması
Esomeprazol zayıf bir bazdır ve parietal hücrenin salgı kanaliküllerinin yüksek asidik ortamında konsantre edilir ve aktif forma dönüştürülür, burada H + K + - ATPaz - asit pompa enzimini inhibe eder ve hem bazal hem de uyarılmış asit sekresyonunu inhibe eder .
farmakodinamik etkiler
20 mg ve 40 mg esomeprazolün oral uygulamasından sonra, etki başlangıcı bir saat içinde gerçekleşir.Beş gün boyunca günde bir kez 20 mg esomeprazol ile tekrarlanan uygulamadan sonra, beşinci gün dozundan 6-7 saat sonra değerlendirildiğinde, pentagastrin stimülasyonundan sonra ortalama doruk asit salgılanması %90 oranında azalır.
20 mg ve 40 mg esomeprazol ile beş günlük oral uygulamadan sonra, semptomatik gastroözofageal reflü hastalığı (GERD) olan hastalarda intragastrik pH, 24 saatin ortalama 13 ve 17 saatinde 4'ün üzerindeki değerlerde tutulur. . En az 8, 12 ve 16 saat boyunca intragastrik pH'ı 4'ün üzerinde tutan hastaların oranı, 20 mg esomeprazol için sırasıyla %76, %54 ve %24'tür. 40 mg esomeprazol için karşılık gelen değerler %97, %92 ve %56 idi.
Plazma konsantrasyonu için bir vekil parametre olarak AUC kullanılarak, asit salgılanmasının inhibisyonu ile ilaca maruz kalma arasında bir korelasyon gösterilmiştir.
Antisekretuar ilaçlarla tedavi sırasında, azalmış asit sekresyonuna yanıt olarak serum gastrin seviyeleri yükselir. Mide asiditesinin azalması nedeniyle CgA düzeyi de artar.
Esomeprazol ile uzun süreli tedavi sırasında bazı hastalarda muhtemelen serum gastrin düzeylerindeki artışa bağlı olarak ECL hücre sayılarında bir artış gözlenmiştir.
ÜFE'ler dahil herhangi bir nedenle mide asiditesinin azalması, mide-bağırsak yolunda normal olarak bulunan bakterilerin mide bakteri yükünü arttırır. SalmonellaVe kampilobakter ve muhtemelen ayrıca Clostridium difficile hastanede yatan hastalarda.
Klinik etkinlik
20 mg esomeprazolün, 2 hafta boyunca her 24 saatte bir doz alan hastalarda sık görülen mide ekşimesi tedavisinde etkili olduğu gösterilmiştir. İki önemli, çok merkezli, randomize, çift kör, plasebo kontrollü çalışmada, yakın zamanda mide ekşimesi öyküsü olan 234 gönüllü, 4 hafta boyunca 20 mg esomeprazol ile tedavi edilmiştir. Asit reflü ile ilişkili semptomlar (mide yanması ve asit regürjitasyonu gibi) 24 saat boyunca geriye dönük olarak değerlendirildi.Her iki çalışmada da, 7 gün içinde mide ekşimesi epizodlarının olmaması olarak tanımlanan, mide ekşimesinin tamamen çözülmesine yönelik birincil son nokta için 20 mg esomeprazol plasebodan önemli ölçüde daha iyiydi. son ziyaretten önceki günler (%33,9 -%41,6 plaseboya karşı %11.9 - %13.7, (hastanın günlüğü, hem 1. haftada istatistiksel olarak anlamlıydı (10 , %0 - %15,2 vs plasebo %0,9 -%2,4, p = 0.014, p
1. ve 2. haftalarda mide ekşimesi rahatlaması, 1. ve 2. haftalarda 24 saatlik mide ekşimesi olmayan günlerin yüzdesi, 1. ve 2. haftalarda ortalama mide ekşimesi şiddeti ve mide ekşimesinin ilk çözümünü elde etme süresi dahil olmak üzere diğer ikincil sonlanım noktaları birincil sonlanım noktasını destekledi. 24 saat içinde ve gece boyunca ve ayrıca plaseboya kıyasla kalıcı bir mide ekşimesi çözümü. 20 mg esomeprazol alan hastaların yaklaşık %78'i, plasebo için %52-58 ile karşılaştırıldığında, tedavinin ilk haftasında mide ekşimesinin düzeldiğini bildirmiştir. Kaydedilen mide ekşimesi olmaksızın ilk 7 ardışık gün olarak tanımlanan mide ekşimesinin kalıcı şekilde çözülmesine ulaşma süresi, 20 mg esomeprazol grubunda önemli ölçüde daha kısaydı (14. günde %39.7 -%48.7, plasebo %11.0 - %20.2). Mide ekşimesinin ilk çözülmesine kadar geçen medyan süre 1 gündü, bir çalışmada plaseboya kıyasla istatistiksel olarak anlamlı (p = 0.048) ve diğerinde anlamlılığa yakın (p = 0.069) Gecelerin yaklaşık %80'i serbestti.Tüm tedavilerde mide ekşimesi plasebo grubundaki %72.4-78.3 ile karşılaştırıldığında, her çalışmanın 2. haftasında adet dönemleri ve gecelerin %90'ı mide ekşimesi yaşamamıştır. Araştırmacıların mide ekşimesi çözünürlüğü derecelendirmeleri deneklerin derecelendirmeleriyle tutarlıydı ve esomeprazol (%34.7 -%41.8) ile plasebo (%8.0 -%11.4) arasında istatistiksel olarak anlamlı farklılıklar gösterdi. Araştırmacılar ayrıca, 2. hafta değerlendirmesi sırasında esomeprazolün asit yetersizliğini çözmede (%58,5 - %63.6'ya karşı plasebo %28,3 -%37,4) plasebodan önemli ölçüde daha etkili olduğunu bulmuşlardır.
Tedavinin 2. haftasında hastaların Genel Tedavi Değerlendirmesini (OTE) takiben, plasebo grubunun %72.4-78,3'üne kıyasla, 20 mg esomeprazol alan hastaların %78.0-80.7'si durumlarında iyileşme bildirmiştir. Bunların çoğu, günlük aktivitelerini gerçekleştirirken Önemli'den Çok Önemli'ye bu değişikliğin önemini düşündüler (2. haftada %79-86).
05.2 Farmakokinetik özellikler
absorpsiyon
Esomeprazol asidik ortama duyarlıdır ve ağızdan mideye dirençli granüller halinde uygulanır. canlılarda R-izomerine dönüşüm önemsizdir. Esomeprazolün emilimi hızlıdır ve doruk plazma seviyeleri dozdan yaklaşık 1-2 saat sonra meydana gelir. Toplam biyoyararlanım tek bir 40 mg dozdan sonra %64'tür ve tekrarlanan günlük dozlamadan sonra %89'a yükselir.20 mg esomeprazol dozu için karşılık gelen değerler sırasıyla %50 ve %68'dir.L Gıda alımı emilimi geciktirir ve azaltır esomeprazolün intragastrik asitlik üzerindeki etkisi üzerinde önemli bir etkisi olmamasına rağmen.
Dağıtım
Sağlıklı deneklerde görünen kararlı durum dağılım hacmi yaklaşık olarak 0.22 L/kg vücut ağırlığıdır. Esomeprazolün %97'si plazma proteinlerine bağlanır.
biyotransformasyon
Esomeprazol, sitokrom P450 (CYP) sistemi tarafından tamamen metabolize edilir Esomeprazolün metabolizmasının çoğu, esomeprazolün hidroksi ve desmetil metabolitlerinin oluşumundan sorumlu polimorfik olarak eksprese edilen CYP2C19'a bağlıdır. Ana plazma metaboliti olan esomeprazol sülfonatın oluşumu.
Eliminasyon
Aşağıdaki parametreler temel olarak fonksiyonel CYP2C19 enzimi olan ve hızlı metabolize eden bireylerdeki farmakokinetiği yansıtır.
Toplam plazma klirensi, tek bir dozdan sonra yaklaşık 17 L/saat ve tekrarlanan uygulamadan sonra yaklaşık 9 L/saat'tir. Plazma eliminasyon yarı ömrü, tekrarlanan günlük dozlardan sonra yaklaşık 1.3 saattir.Esomeprazol, günde bir kez verildiğinde birikme eğilimi olmaksızın, dozlar arasında plazmadan tamamen temizlenir.Esomeprazolün ana metabolitlerinin mide asidi salgılanması üzerinde hiçbir etkisi yoktur. Oral esomeprazol dozunun yaklaşık %80'i metabolitler olarak idrarla atılır, geri kalanı feçeste bulunur Ana ilacın %1'den azı idrarda bulunur.
Doğrusallık / Doğrusal olmama
Esomeprazolün farmakokinetiği günde iki kez 40 mg'a kadar olan dozlarda incelenmiştir. Plazma konsantrasyonu-zaman eğrisi altında kalan alan, tekrarlayan esomeprazol uygulamasıyla artar Bu artış doza bağlıdır ve tekrarlanan uygulamadan sonra EAA'da dozla orantılı bir artıştan daha fazlasına yol açar. Bu doza bağımlılık ve zamana bağımlılık, muhtemelen esomeprazol ve/veya sülfonat metabolitinin neden olduğu CYP2C19 enziminin inhibisyonuna bağlı olarak ilk geçiş metabolizmasındaki ve sistemik klirensteki azalmadan kaynaklanmaktadır.
Özel hasta popülasyonu
Yavaş metabolizörler
Nüfusun yaklaşık %2,9 ± 1,5'i CYP2C19 enziminin yetersiz işlevine sahiptir ve bunlar zayıf metabolize ediciler olarak adlandırılır Bu bireylerde, esomeprazolün metabolizmasının birincil olarak CYP3A4 tarafından katalize edilmesi muhtemeldir. 40 mg esomeprazolün tekrarlanan günlük dozlamasından sonra, plazma konsantrasyonu-zaman eğrisinin altındaki ortalama alan, yavaş metabolize edenlerde, fonksiyonel CYP2C19 enzimi (yaygın metabolizörler) olan deneklere göre yaklaşık %100 daha yüksekti. Ortalama doruk plazma konsantrasyonu yaklaşık %60 daha yüksekti.
Bu gözlemlerin esomeprazolün pozolojisi üzerinde hiçbir etkisi yoktur.
Seks
Tek bir 40 mg esomeprazol dozundan sonra, plazma konsantrasyonu/zaman eğrisi altındaki ortalama alan, kadınlarda erkeklere göre yaklaşık %30 daha yüksektir.Tekrarlanan günlük dozlardan sonra cinsiyet farkı gözlenmemiştir.Bu gözlemlerin esomeprazol pozolojisi için herhangi bir etkisi yoktur.
Karaciğer yetmezliği
Hafif ila orta derecede karaciğer fonksiyon bozukluğu olan hastalarda esomeprazolün metabolizması bozulabilir. Şiddetli karaciğer fonksiyon bozukluğu olan hastalarda metabolik hız azalır ve esomeprazol için plazma konsantrasyon-zaman eğrisi altındaki alanın iki katına çıkmasıyla sonuçlanır. Bu nedenle şiddetli disfonksiyonu olan hastalarda maksimum doz olan 20 mg aşılmamalıdır. Esomeprazol ve ana metabolitleri, günde bir kez verildiğinde birikme eğilimi göstermez.
Böbrek yetmezliği
Böbrek fonksiyon bozukluğu olan hastalarda herhangi bir çalışma yapılmamıştır. Böbrek, esomeprazolün metabolitlerinin atılımından sorumlu olduğu, ancak ana bileşiğin eliminasyonundan sorumlu olmadığı için, böbrek fonksiyon bozukluğu olan hastalarda esomeprazolün metabolizmasının etkilenmesi beklenmez.
Yaşlı hastalar (≥65 yaş)
Esomeprazolün metabolizması yaşlı hastalarda (71-80 yaş) önemli ölçüde değişmez.
05.3 Klinik öncesi güvenlik verileri
Güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite ve üreme ve gelişme toksisitesine ilişkin konvansiyonel çalışmalara dayanan klinik olmayan veriler, insanlar için özel bir tehlike ortaya koymamaktadır.
Klinik çalışmalarda gözlenmeyen, ancak klinik maruziyet düzeyine benzer düzeylere maruz kalan hayvanlarda bulunan ve olası klinik önemi olan advers reaksiyonlar aşağıdaki gibidir:
Rasemik karışımla tedavi edilen sıçanlarda yapılan karsinojenisite çalışmaları, "mide ECL hücrelerinin ve karsinoidlerin hiperplazisini ortaya çıkardı. Sıçanlarda gözlenen bu gastrik etkiler, azalan gastrik asit üretimine sekonder yüksek, belirgin bir hipergastrineminin sonucudur ve sıçanlarda uzun süre sonra gözlenmiştir. - mide asidi salgısı inhibitörleri ile süreli tedavi.
06.0 FARMASÖTİK BİLGİLER
06.1 Yardımcı maddeler
Gliserol monostearat 40-55,
hiproloz,
hipromelloz,
demir oksit (kırmızı-kahverengi) (E 172),
demir oksit (sarı) (E 172)
magnezyum stearat,
%30'da kopolimerize metakrilik asit etil akrilat (1: 1) dispersiyonu,
mikrokristal selüloz,
sentetik parafin,
makrogol 6000,
polisorbat 80,
krospovidon (Tip A),
sodyum stearil fumarat,
şeker topları (sakaroz),
talk,
titanyum dioksit (E 171),
trietil sitrat.
06.2 Uyumsuzluk
İlgili değil.
06.3 Geçerlilik süresi
3 yıl
06.4 Depolama için özel önlemler
30°C'nin üzerinde saklamayın.
Nemden korumak için orijinal blisterinde saklayın.
06.5 İç ambalajın yapısı ve paketin içeriği
Alüminyum blister. 7 ve 14 tabletlik paketler.
Tüm paket boyutları pazarlanmayabilir.
06.6 Kullanım ve kullanım talimatları
Özel talimat yok.
07.0 PAZARLAMA YETKİ SAHİBİ
Pfizer Tüketici Sağlığı Ltd.
Ramsgate Yolu
Sandviç
Kent
CT13 9NJ Birleşik Krallık
08.0 PAZARLAMA YETKİ NUMARASI
AB / 1/13/860/001 - AIC 042922017
AB / 1/13/860/002 - AIC 042922029
09.0 İLK İZİN VEYA İZİNİN YENİLENMESİ TARİHİ
İlk izin tarihi: 26 Ağustos 2013
10.0 METİN REVİZYON TARİHİ
23 Ocak 2014













.jpg)




.jpg)