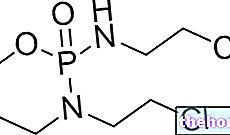
Aktif maddeler: Tamsulosin
Lura 0.4 mg modifiye salımlı sert kapsüller
Endikasyonları Lura neden kullanılır? Bu ne için?
Lura, idrarın geçişini ve atılmasını kolaylaştırarak prostat ve üretra kaslarının gerginliğini azaltan alfa1 adrenerjik reseptör antagonistleri olarak adlandırılan ilaçlar kategorisine ait olan aktif bileşen tamsulosin hidroklorür içerir.
Lura, erkeklerde prostat büyümesi (iyi huylu prostat hiperplazisi) ile ilişkili alt idrar yolu semptomlarını tedavi etmek için kullanılır.
Kontrendikasyonlar Lura kullanılmamalıdır
Lura'yı alma
- Bu ilacın etkin maddesine veya diğer bileşenlerinden herhangi birine karşı alerjiniz varsa (bölüm 6'da listelenmiştir). Aşırı duyarlılık, vücudun yumuşak kısımlarının (örneğin boğaz veya dil) ani lokal şişmesi, bazen kaşınmanın eşlik ettiği nefes alma güçlüğü (anjiyoödem) ile de kendini gösterir.
- Şiddetli karaciğer problemleriniz varsa (ciddi karaciğer yetmezliği);
- Oturarak veya yatarak kan basıncınızı düşürmede sorun yaşadıysanız (ortostatik hipotansiyon).
Kullanım Önlemleri Lura'yı almadan önce bilmeniz gerekenler
Lura'yı almadan önce doktorunuzla veya eczacınızla konuşun.
- Bu tür diğer ilaçlarda olduğu gibi, Lura ile özel durumlarda kan basıncınızda düşüş olabilir ve nadiren bayılabilirsiniz. Baş dönmesi ve halsizlik gibi düşük tansiyonun (ortostatik hipotansiyon) ilk belirtilerinde, semptomlar ortadan kalkana kadar oturmanız veya uzanmanız gerekir.
- Lura ile tedaviye başlamadan önce, doktorunuz spesifik testler aracılığıyla prostat büyümesiyle (iyi huylu prostat hiperplazisi) aynı semptomlara neden olabilecek diğer durumların varlığını ekarte etmek zorunda kalacaktır.
- Şiddetli böbrek problemleriniz varsa, ilaç bu kişilerde çalışılmadığından doktorunuz özel dikkat gösterecektir.
- Lens bulanıklığı (katarakt) için göz ameliyatı olmanız gerekiyorsa, Lura aldıysanız veya alıyorsanız, ameliyatı yapacak olan doktorunuza söyleyin, çünkü ilacı almak ameliyat sırasında ve sonrasında cerrahi komplikasyonları artırabilir. . Doktorunuz ilaçla ilgili uygun önlemleri alabilir. Göz ameliyatı geçirmeden önce tedaviyi ertelemeniz veya geçici olarak durdurmanız gerekip gerekmediğini doktorunuza sorun.
- Tablet kalıntılarının dışkıda bulunması mümkündür.
Çocuklar ve ergenler
Lura çocuklar için uygun değildir. Lura'nın 18 yaşın altındaki çocuklarda güvenliği ve etkinliği belirlenmemiştir.
Etkileşimler Hangi ilaçlar veya yiyecekler Lura'nın etkisini değiştirebilir?
Başka ilaçlar alıyorsanız, yakın zamanda aldıysanız veya alma ihtimaliniz varsa doktorunuza veya eczacınıza söyleyiniz. Özellikle aşağıdaki ilaçlardan herhangi birini alıyorsanız dikkatli olun:
- simetidin (mide asidini tedavi eden bir ilaç)
- furosemid (diüretik) Diklofenak (iltihap ve ağrı için) ve varfarin (kanı inceltmek için), çünkü bunlar Lura'nın eliminasyon oranını artırabilir.
- Lura'nın etkisini artırabileceklerinden ketokonazol (mantar enfeksiyonlarının tedavisi için) veya paroksetin (depresyon için).
- Aynı sınıfa ait diğer ilaçlar (alfa1-adrenoseptör antagonistleri), çünkü bunlar kan basıncında düşüşe neden olabilir.
Uyarılar Şunları bilmek önemlidir:
Hamilelik, emzirme ve doğurganlık
Lura kadın hastalar için uygun değildir.
Erkekte anormal boşalma (boşalma bozuklukları) bildirilmiştir. Bu, seminal sıvının üretra yoluyla vücudu terk etmediği, mesaneye girdiği (retrograd ejakülasyon) veya ejakülasyon hacminin azaldığı veya olmadığı (ejakülasyon başarısızlığı) anlamına gelir.
Araç ve makine kullanma
Lura'yı aldıktan sonra baş dönmesi olabilir, bu durumda dikkat gerektiren faaliyetlerde bulunmamalısınız.
Doz, Yöntem ve Uygulama Süresi Lura Nasıl Kullanılır: Pozoloji
Bu ilacı her zaman tam olarak doktorunuzun veya eczacınızın size söylediği şekilde alınız. Şüpheniz varsa, doktorunuza veya eczacınıza danışın. Önerilen doz, kahvaltıdan sonra veya günün ilk öğününden sonra alınacak günde bir kapsüldür.
Kapsül bütün olarak yutulmalı ve ezilmemeli veya çiğnenmemelidir, çünkü bu, aktif bileşenin değiştirilmiş salınımına müdahale edebilir.
Çocuklarda ve ergenlerde kullanım
Lura, 18 yaşın altındaki çocuklar ve ergenler için endike değildir.
Lura'yı almayı unutursanız
Unutulan bir kapsülü telafi etmek için çift doz almayınız.
Bu ilacın kullanımıyla ilgili başka sorularınız varsa, doktorunuza veya eczacınıza sorunuz.
Aşırı doz Çok fazla Lura aldıysanız ne yapmalısınız?
Kullanmanız gerekenden daha fazla Lura kullandıysanız, farklı doz aşımı seviyelerinde gözlenen kan basıncınızda ciddi düşüşler olabilir.
Lura'nın yanlışlıkla yutulması/aşırı dozda alınması durumunda derhal doktorunuza haber veriniz veya size en yakın hastaneye başvurunuz.
Yan Etkiler Lura'nın yan etkileri nelerdir?
Tüm ilaçlar gibi, bu ilaç da yan etkilere neden olabilir, ancak bunları herkes almayabilir.
Aşağıdaki yan etkiler gözlemlenmiştir:
Yaygın yan etkiler (10 kişiden 1'ini etkileyebilir)
- baş dönmesi
- boşalma bozuklukları
Yaygın olmayan yan etkiler (100 kişiden 1'ini etkileyebilir)
- baş ağrısı (baş ağrısı)
- fark edilir ve sık kalp atışı (çarpıntı)
- oturma veya yatmadan ayakta durmaya geçerken kan basıncında azalma (ortostatik hipopotansiyel)
- burun akıntısı ve tıkalı burun (rinit)
- kabızlık, ishal, bulantı, kusma
- döküntü, kaşıntı, kurdeşen
- zayıflık (asteni)
Seyrek yan etkiler (1000 kişiden 1'ini etkileyebilir)
bayılma (senkop)
vücudun yumuşak kısımlarının ani şişmesi (örneğin boyun ve dil), kaşıntılı veya kaşıntısız nefes almada zorluk ve ciltte kızarıklık (anjiyoödem)
Çok seyrek yan etkiler (10.000 kişiden 1'ini etkileyebilir)
- deri döküntüsü, iltihaplanma, ciltte ve/veya dudaklarda, gözlerde, ağızda, burun deliklerinde veya cinsel organlarda su toplaması (Steven-Johnson sendromu)
- uzun süreli ve ağrılı penil ereksiyon (priapizm)
Sıklığı bilinmeyen istenmeyen etkiler (mevcut verilerden sıklık tahmin edilemiyor):
- bulanık görme, görme bozukluğu
- burun kanaması (burun kanaması)
- kuru ağız
- şiddetli deri döküntüleri (eritema multiforme, eksfolyatif dermatit)
- boşalma bozukluğu, mesanede seminal sıvı (geriye doğru boşalma), boşalma başarısızlığı.
- anormal kalp ritmi (atriyal fibrilasyon, aritmi, taşikardi)
- nefes almada zorluk (dispne).
Cerrahi komplikasyonlar ("İntraoperatif Bayrak İris Sendromu" - IFIS olarak bilinen küçük göz bebeği sendromu) göz ameliyatı sırasında lens opaklığı (katarakt) ve önlemler nedeniyle Lura tedavisi ile ilişkilendirilmiştir.
Yan etkilerin raporlanması
Herhangi bir yan etki yaşarsanız, doktorunuzla veya eczacınızla konuşun.Bu broşürde listelenmeyen olası yan etkiler de buna dahildir. Yan etkileri doğrudan www.agenziafarmaco.it/it/responsabili adresindeki ulusal raporlama sistemi aracılığıyla da bildirebilirsiniz.Yan etkileri bildirerek bu ilacın güvenliği hakkında daha fazla bilgi sağlamaya yardımcı olabilirsiniz.
Son Kullanma ve Saklama
Bu ilacı çocukların göremeyeceği ve erişemeyeceği bir yerde saklayın.
30 ° C'yi aşmayan bir sıcaklıkta saklayın.
Bu ilacı karton üzerinde belirtilen "son kullanma tarihinden" sonra kullanmayınız. Son kullanma tarihi, o ayın son gününü ifade eder.
Herhangi bir ilacı atık su veya evsel atık yoluyla atmayın.Artık kullanmadığınız ilaçları nasıl atacağınızı eczacınıza sorun.Bu çevrenin korunmasına yardımcı olacaktır.
Diğer bilgiler
Lura'nın içeriği
Etkin madde tamsulosin hidroklorürdür: 1 kapsül 0.4 mg tamsulosin hidroklorür içerir.
Diğer bileşenler şunlardır: mikrokristal selüloz, metakrilik asit - etil akrilat kopolimer (1: 1), polisorbat 80, sodyum lauril sülfat, triasetin, talk, kalsiyum stearat. Sert kapsül şunlardan oluşur: jelatin, titanyum dioksit (E 171), indigo karmin (E 132), sarı demir oksit (E 172), kırmızı demir oksit (E 172), siyah demir oksit (E 172).
Lura'nın görünümünün ve paketin içeriğinin açıklaması
Modifiye salımlı kapsül, sert - Blister ambalajlarda 20 kapsüllük kutu.
Kaynak Paket Broşürü: AIFA (İtalyan İlaç Ajansı). Ocak 2016'da yayınlanan içerik. Mevcut bilgiler güncel olmayabilir.
En güncel sürüme erişmek için AIFA (İtalyan İlaç Ajansı) web sitesine erişmeniz önerilir. Sorumluluk reddi ve faydalı bilgiler.
01.0 TIBBİ ÜRÜNÜN ADI
LURA 0.4 MG MODİFİYE YAYIN KAPSÜLLERİ
02.0 KALİTATİF VE KANTİTATİF BİLEŞİM
Her modifiye salımlı kapsül, aktif bileşen olarak 0.4 mg tamsulosin hidroklorür içerir.
Yardımcı maddeler: Yardımcı maddelerin tam listesi için bkz. bölüm 6.1.
03.0 FARMASÖTİK FORM
Modifiye salımlı kapsül, sert
04.0 KLİNİK BİLGİLER
04.1 Terapötik endikasyonlar
Benign prostat hiperplazisi (BPH) ile ilişkili Alt İdrar Yolu Semptomları (AÜSS).
04.2 Pozoloji ve uygulama yöntemi
Ağızdan kullanım
Kahvaltıdan sonra veya günün ilk öğününden sonra günde bir kapsül alınır. Kapsül bütün olarak yutulmalıdır.
Kapsüller ezilmemeli veya çiğnenmemelidir, çünkü bu, aktif bileşenin değiştirilmiş salınımına müdahale edebilir. Böbrek yetmezliği durumunda doz ayarlaması gerekli değildir. Hafif ila orta derecede karaciğer yetmezliği durumunda doz ayarlaması gerekli değildir (ayrıca bkz. bölüm 4.3 Kontrendikasyonlar).
Pediatrik popülasyon
LURA'nın çocuklarda spesifik kullanımına ilişkin bir gösterge yoktur. Çocuklarda tamsulosinin güvenliği ve etkinliği
04.3 Kontrendikasyonlar
İlaca bağlı anjiyoödem veya yardımcı maddelerden herhangi birine karşı tamsulosin hidroklorüre karşı aşırı duyarlılık.
Ortostatik hipotansiyon tarihi.
Şiddetli karaciğer yetmezliği.
04.4 Özel uyarılar ve uygun kullanım önlemleri
Diğer alfa 1 adrenoseptör antagonistlerinde olduğu gibi, LURA tedavisi sırasında özel durumlarda kan basıncında düşme meydana gelebilir ve bu durum nadiren senkopa neden olabilir. Ortostatik hipotansiyonun (baş dönmesi, halsizlik) ilk belirtilerinde, semptomlar ortadan kalkana kadar hasta oturmalı veya uzanmalıdır.
LURA ile tedaviye başlamadan önce hasta, benign prostat hiperplazisi ile aynı semptomlara neden olabilecek diğer durumların varlığı açısından değerlendirilmelidir.
Tedaviye başlamadan önce ve sonrasında düzenli aralıklarla rektal muayene ve gerekirse prostat spesifik antijen (PSA) tayini yapılmalıdır. Şiddetli böbrek yetmezliği (kreatinin klerensi 10 ml/dak'dan az) olan hastaların tedavisi, tıbbi ürün bu deneklerde çalışılmadığından dikkatle düşünülmelidir. Katarakt ameliyatı sırasında, daha önce tamsulosin içeren ilaçlarla tedavi edilen veya tedavi edilen bazı hastalar, disket iris olarak bilinen IFIS "İntraoperatif Floppy İris Sendromu" yaşadı. Bu sendromun ortaya çıkması ameliyat sırasında ve sonrasında cerrahi komplikasyonları artırabilir, bu nedenle katarakt ameliyatı bekleyen hastalarda tamsulosin tedavisine başlanmaması önerilir.
Anekdot deneyimleri, ameliyattan 1 veya 2 hafta önce tamsulosin tedavisinin kesilmesinin yardımcı olabileceğini göstermiştir. Ancak, askıya almanın sağlayacağı fayda ve gerekli kesinti süresi henüz tesis edilmemiştir. IFIS, katarakt ameliyatından önce tamsulosini daha uzun süre bırakan hastalarda da bulunmuştur.
Ameliyat öncesi değerlendirme aşamasında, doktor, ameliyat sırasında IFIS'nin yönetimi için uygun önlemleri sağlamak için ameliyat edilecek hastanın tamsulosin ile tedavi edilip edilmediğini veya tedavi altında olup olmadığını araştırmalıdır.
Tamsulosin hidroklorür, zayıf metabolize eden CYP2D6 fenotipi olan hastalarda güçlü CYP3A4 inhibitörleri ile birlikte uygulanmamalıdır.
Tamsulosin hidroklorür, güçlü ve orta derecede CYP3A4 inhibitörleri ile kombinasyon halinde dikkatli kullanılmalıdır (bkz. bölüm 4.5).
Tablet kalıntılarının dışkıda bulunması mümkündür.
04.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim biçimleri
Etkileşim çalışmaları sadece yetişkinlerde yapılmıştır.
Tamsulosin, atenolol, enalapril veya nifedipin veya teofilin ile birlikte alındığında hiçbir etkileşim kaydedilmemiştir.
Simetidin ile birlikte kullanımı plazma tamsulosin seviyelerinde bir artışa neden olurken, furosemid onları düşürür; bununla birlikte, tamsulosinin plazma konsantrasyon seviyeleri terapötik aralık içindedir ve bu nedenle herhangi bir doz ayarlaması gerekli değildir.
Laboratuvar ortamında diazepam, propranolol, triklormetiazid, klormadinon, amitriptilin, diklofenak, glibenklamid, simvastatin ve varfarin, insan plazmasındaki tamsulosinin serbest fraksiyonunu değiştirmez. Tamsulosin, diazepam, propranolol, triklormetiazid ve klormadinonun serbest fraksiyonunu değiştirmez. çalışmalarda laboratuvar ortamında amitriptilin, salbutamol, glibenklamid ve finasterid ile mikrozomal hepatik fraksiyonlar (sitokrom P450'ye bağlı ilaç metabolizasyon enzim sistemini temsil eder) ile hepatik metabolizma düzeyinde hiçbir etkileşim gösterilmemiştir. Ancak diklofenak ve varfarin, tamsulosinin eliminasyon hızını artırabilir.
Tamsulosin hidroklorür ve güçlü CYP3A4 inhibitörlerinin birlikte uygulanması, tamsulosin hidroklorür maruziyetinin artmasına neden olabilir. Ketokonazol (bilinen güçlü bir CYP3A4 inhibitörü) ile eşzamanlı uygulama, tamsulosin hidroklorürün EAA ve Cmaks'ında sırasıyla 2,8 ve 2,2 kat artışla sonuçlanmıştır.
Tamsulosin hidroklorür, zayıf metabolize eden CYP2D6 fenotipi olan hastalarda güçlü CYP3A4 inhibitörleri ile birlikte uygulanmamalıdır.
Tamsulosin hidroklorür, güçlü ve orta dereceli CYP3A4 inhibitörleri ile kombinasyon halinde dikkatli kullanılmalıdır.
Tamsulosin hidroklorür ve güçlü bir CYP2D6 inhibitörü olan paroksetinin birlikte uygulanması, tamsulosin Cmaks ve EAA değerlerinde sırasıyla 1,3 ve 1,6 kat artışla sonuçlanmıştır, ancak bu artışlar klinik olarak anlamlı kabul edilmemektedir. Diğer alfa1 adrenoseptör antagonistlerinin eşzamanlı kullanımı hipotansif etkilere yol açabilir.
04.6 Hamilelik ve emzirme
LURA sadece erkek hastalarda kullanım için olduğundan ilgili değildir.
Tamsulosin hidroklorür ile yapılan kısa ve uzun süreli klinik çalışmalarda boşalma bozuklukları gözlenmiştir.Yetkilendirme sonrası çalışmalarda boşalma bozuklukları, retrograd boşalma ve boşalma yetersizliği vakaları bildirilmiştir.
04.7 Araç ve makine kullanma yeteneği üzerindeki etkiler
Araç ve makine kullanımı ile ilgili herhangi bir çalışma yapılmamıştır.. Ancak hasta vertigo oluşma ihtimalinin farkında olmalıdır.
04.8 İstenmeyen etkiler
Katarakt cerrahisi sırasında, pazarlama sonrası sürveyans döneminde tamsulosin tedavisiyle ilişkili "İntraoperatif Bayrak İris Sendromu" (IFIS) olarak bilinen küçük göz bebeği sendromunun bir varyantı gözlenmiştir (ayrıca bkz. paragraf 4.4).
Pazarlama sonrası deneyim: Yukarıda listelenen advers olaylara ek olarak, tamsulosin kullanımına bağlı olarak atriyal fibrilasyon, aritmi, taşikardi ve dispne bildirilmiştir.Spontan olarak bildirilen bu olaylar tüm dünyada pazarlama sonrası deneyimlerden kaynaklandığı için, sıklığı ve bunlara neden olmada tamsulosinin rolü kesin olarak belirlenemez.
04.9 Doz aşımı
Belirtiler
Tamsulosin hidroklorür ile doz aşımı potansiyel olarak ciddi hipotansif etkilere yol açabilir.
Farklı doz aşımı seviyelerinde ciddi hipotansif etkiler gözlenmiştir.
Tedavi
Doz aşımı sonrasında akut hipotansiyon durumunda, kardiyovasküler düzeyde acil önlem alınmalıdır. Hastayı yatırarak kan basıncı ve kalp hızı normale döndürülebilir. Bu yeterli olmazsa hacim genişleticiler ve gerekirse vazokonstrüktif ilaçlar kullanılabilir. Böbrek fonksiyonu izlenmeli ve genel destekleyici önlemler uygulanmalıdır. Tamsulosin, plazma proteinlerine güçlü bir şekilde bağlandığından diyalizin pek faydası yoktur. Emilimi önlemek için kusma gibi bazı önlemler alınabilir.
Yüksek dozlarda yutulması durumunda gastrik lavaj yararlı olabilir ve aktif kömür ve sodyum sülfat gibi ozmotik bir müshil uygulanabilir.
05.0 FARMAKOLOJİK ÖZELLİKLER
05.1 Farmakodinamik özellikler
Farmakoterapötik grup: alfa1 adrenoseptör antagonisti.
ATC kodu: G04CA02 - Prostat bozukluklarının özel tedavisi için ilaçlar - Tamsulosin.
Etki mekanizması: tamsulosin, postsinaptik alfa1 adrenoseptörlerine, özellikle prostat ve üretranın düz kas gevşemesine neden olan alfa1A ve alfa1D alt tiplerine seçici ve rekabetçi bir şekilde bağlanır.
Farmakodinamik Etkiler: Tamsulosin 0.4 mg maksimum idrar akışını arttırır. Prostat ve üretradaki düz kasları gevşeterek tıkanıklığı giderir, böylece işeme semptomlarını iyileştirir. Ayrıca mesane instabilitesinin önemli bir rol oynadığı dolum semptomlarını da iyileştirir.
Doldurma ve boşaltma semptomları üzerindeki bu etkiler, uzun süreli tedavi sırasında korunur. Ameliyat veya kateterizasyon ihtiyacı önemli ölçüde gecikir.
Alfa1 adrenoseptör antagonistleri, periferik direnci azaltarak kan basıncını düşürebilir. Tamsulosin ile yapılan klinik deneyler sırasında kan basıncında klinik olarak anlamlı bir azalma gözlenmemiştir.
Pediatrik popülasyon
Nöropatik mesanesi olan çocuklarda çift kör, randomize, plasebo kontrollü bir doz aralığı çalışması yürütülmüştür.Toplam 161 çocuk (2-16 yaş arası) randomize edilmiş ve 3 doz seviyesinden birine (düşük [0.001]) tamsulosin ile tedavi edilmiştir. ila 0,002 mg/kg], orta [0,002 ila 0,004 mg/kg] ve yüksek [0,004 ila 0,008 mg/kg]) veya plasebo ile Birincil son nokta, kaybolma noktası detrüsör basıncı (detrusor sızıntı noktası basıncı, LPP), kateterizasyon günlüklerinde kaydedildiği gibi, hidronefroz ve hidroüreter stabil hale gelene ve kateterizasyondan elde edilen idrar hacimlerindeki ve kateterizasyon sırasındaki idrar sızıntılarının sayısındaki değişime kadar azaldı. Plasebo grubu ile 3 tamsulosin grubundan herhangi biri arasında birincil veya ikincil sonlanım noktaları açısından anlamlı bir fark yoktu.Herhangi bir doz seviyesi için doz yanıtı gözlenmedi.
05.2 Farmakokinetik özellikler
absorpsiyon
Tamsulosin bağırsaktan emilir ve neredeyse tamamen biyolojik olarak kullanılabilir.
Tamsulosin hidroklorürün öğünlere yakın alınması emilimi azaltır.
Hasta ürünü her zaman aynı yemekten sonra alırsa tek tip emilim sağlanabilir.
Tamsulosin lineer kinetik sergiler.
Tok haldeyken tek bir tamsulosin dozundan sonra, plazma tamsulosin seviyeleri yaklaşık 6 saatte pik yapar ve 5 günlük tedaviden sonra ulaşılan kararlı durum koşullarında Cmax, tek dozdan sonra elde edilenden yaklaşık 2/3 daha yüksektir.
Bu yaşlı hastalarda not edilmiştir ve daha genç hastalarda da aynısını beklemek mantıklıdır.
Hem tekli hem de tekrarlı dozlamadan sonra plazma seviyelerinde önemli bireysel farklılıklar vardır.
Dağıtım
İnsanlarda tamsulosin plazma proteinlerine yaklaşık %99 oranında bağlanır ve dağılım hacmi düşüktür (yaklaşık 0,2 l/kg).
biyotransformasyon
Tamsulosin yavaş metabolize edildiğinden ilk geçiş etkisi zayıftır.
Tamsulosin, plazmada esas olarak değişmemiş aktif bileşen formunda bulunur.
Karaciğerde metabolize edilir.
Sıçanlarda, tamsulosinin neden olduğu mikrozomal karaciğer enzim sisteminin hemen hemen hiçbir indüksiyonu gözlenmedi. İn vitro sonuçlar, CYP3A4 ve ayrıca CYP2D6'nın, diğer CYP izoenzimleri tarafından tamsulosin hidroklorür metabolizmasına olası küçük katkılarla birlikte metabolizmaya dahil olduğunu göstermektedir. İlaç metabolize eden enzimler CYP3A4 ve CYP2D6'nın inhibisyonu, tamsulosin hidroklorür maruziyetinin artmasına neden olabilir (bkz. bölüm 4.4 ve 4.5).
Metabolitlerin hiçbiri orijinal üründen daha aktif değildir.
Eliminasyon
Tamsulosin ve metabolitleri esas olarak idrarla atılır ve alınan ilacın yaklaşık %9'u değişmemiş formda atılır.
Tokluk ve kararlı durum koşullarında 0.4 mg'lık tek bir tamsulosin dozundan sonra, eliminasyon yarı ömürleri sırasıyla 10 ve 13 saatte ölçülmüştür.
05.3 Klinik öncesi güvenlik verileri
Farelerde, sıçanlarda ve köpeklerde tekli ve tekrarlı doz toksisite çalışmaları yapılmıştır. Sıçanlarda üreme çalışmaları, fare ve sıçanlarda karsinojenisite çalışmaları, genotoksisite çalışmaları da dikkate alındı. laboratuvar ortamında Ve canlıda.
Tamsulosin'in daha yüksek dozları ile belirlenen genel toksikolojik profil, alfa1 adrenoseptör antagonist ilaçların bilinen farmakolojik aktivitesi ile tutarlıdır. Köpeklerde çok yüksek dozlarda elektrokardiyogram değiştirilir Bu yanıtın klinik olarak anlamlı olmadığı kabul edilir.
Tamsulosin ilgili genotoksik özellikler göstermedi.
Dişi sıçan ve farelerin memelerinde proliferatif değişikliklerin insidansında artış bildirilmiştir. Muhtemelen hiperprolaktineminin aracılık ettiği ve sadece yüksek dozlarda ortaya çıkan bu bulguların alakasız olduğu düşünülmektedir.
06.0 FARMASÖTİK BİLGİLER
06.1 Yardımcı maddeler
Mikrokristalin selüloz, Metakrilik asit - etil akrilat kopolimer (1: 1), Polisorbat 80, Sodyum lauril sülfat, Triasetin, Talk, Kalsiyum stearat.
sert kapsül: jelatin, titanyum dioksit (E 171), indigo karmin (E 132), sarı demir oksit (E 172), kırmızı demir oksit (E 172), siyah demir oksit (E 172).
06.2 Uyumsuzluk
İlgili değil.
06.3 Geçerlilik süresi
2 yıl.
06.4 Depolama için özel önlemler
30 ° C'yi aşmayan bir sıcaklıkta saklayın.
06.5 İç ambalajın yapısı ve paketin içeriği
Taş baskılı karton kutuda PVC / Al ısıyla kapatılmış blister, 20 kapsül.
06.6 Kullanım ve kullanım talimatları
Özel talimat yok.
Kullanılmayan ürün ve bu ilaçtan elde edilen atıklar yerel yasal gerekliliklere uygun olarak atılmalıdır.
07.0 PAZARLAMA YETKİ SAHİBİ
ECUPharma S.r.l
Mazzini ile 20
20123 Milano
08.0 PAZARLAMA YETKİ NUMARASI
LURA
"0.4 MG MODİFİYE EMLAK KAPSÜLLERİ - 20 KAPSÜL AIC N. 036943013
09.0 İLK İZİN VEYA İZİNİN YENİLENMESİ TARİHİ
4 Temmuz 2006
Nisan 2013