Aktif maddeler: Tenofovir disoproksil
Viread 163 mg film kaplı tabletler
Paket boyutları için Viread paket ekleri mevcuttur:- Viread 123 mg film kaplı tabletler
- Viread 163 mg film kaplı tabletler
- Viread 204 mg film kaplı tabletler
- Viread 245 mg film kaplı tabletler
- Viread 33 mg/g granül
Endikasyonları Viread neden kullanılır? Bu ne için?
Viread, tenofovir disoproksil etkin maddesini içerir. Bu aktif madde, HIV enfeksiyonunu tedavi etmek için kullanılan bir antiretroviral veya antiviral ilaçtır.Tenofovir, jenerik olarak NRTI olarak bilinen bir nükleotid revers transkriptaz inhibitörüdür ve bir enzimin (ters transkriptaz) normal aktivitesine müdahale ederek çalışır. HIV enfeksiyonunun tedavisi için Viread her zaman diğer ilaçlarla birlikte kullanılmalıdır.
Viread 163 mg tabletler, HIV (insan immün yetmezlik virüsü) enfeksiyonu için bir tedavidir.
Viread 163 mg tabletler çocuklarda kullanılmak üzere tasarlanmıştır.Sadece aşağıdakiler için endikedir:
- 6 yaşından 12 yaşına kadar olan çocuklar
- vücut ağırlığı 22 kg ile 28 kg'dan az olanlar
- Direnç gelişmesi nedeniyle artık tam olarak etkili olmayan veya yan etkilere neden olan başka HIV ilaçları ile tedavi görmüş olanlar.
Bu ilaç HIV enfeksiyonu için bir tedavi değildir.Viread alırken çocuğunuz yine de enfeksiyonlara veya HIV enfeksiyonuna bağlı diğer hastalıklara yakalanabilir. Çocuk ayrıca HIV virüsünü başkalarına da bulaştırabilir, bu nedenle diğer insanlara bulaştırmamak için önlem almanız önemlidir.
Kontrendikasyonlar Viread ne zaman kullanılmamalıdır?
Ona Viread vermeyin
- Çocuğunuzun tenofovir, tenofovir disoproksil fumarat veya bu ilacın bölüm 6'da listelenen diğer bileşenlerinden herhangi birine alerjisi varsa.
Böyle bir durumda hemen doktorunuza söyleyiniz ve Viread'i vermeyiniz.
Kullanım Önlemleri Viread'i kullanmadan önce bilmeniz gerekenler
- Viread 163 mg tabletler, yalnızca, direnç gelişmesi nedeniyle artık tam olarak etkili olmayan veya yan etkilere neden olan diğer HIV ilaçlarıyla tedavi edilmiş çocuklar için endikedir.
- Viread 163 mg tabletlerin onlar için uygun olup olmadığını görmek için çocuğunuzun yaşını ve kilosunu kontrol edin, bkz. Çocuklar ve ergenler.
Viread'i vermeden önce doktorunuz veya eczacınız ile konuşunuz.
- Enfeksiyonu başkalarına bulaştırmamaya dikkat edin. Antiretroviral tedavinin etkisi ile risk azaltılsa da çocuk bu ilacı alırken HIV'i bulaştırabilir. İlacın bulaşmasını önlemek için gerekli önlemleri doktorunuzla görüşün. diğer insanlara.
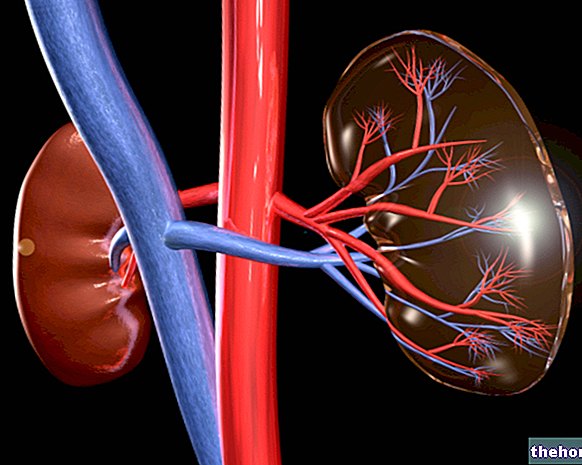
- Çocuğunuzda böbrek hastalığı varsa veya testler böbrek sorunları gösterdiyse doktorunuza veya eczacınıza söyleyin. Halihazırda böbrek problemleri olan çocuklara Viread verilmemelidir. Viread tedavi sırasında böbrekleri etkileyebilir. Tedaviye başlamadan önce doktorunuz böbrek fonksiyonunu değerlendirmek için kan testleri isteyebilir.Doktorunuz ayrıca tedavi sırasında böbreklerin işleyişini izlemek için kan testleri isteyebilir.
Viread, böbreklerinize zarar verebilecek diğer ilaçlarla birlikte alınmamalıdır (Diğer ilaçlar ve Viread bölümüne bakınız). Bu kaçınılmazsa, doktor haftada bir bebeğin böbrek fonksiyonunu izleyecektir.
- Kemik sorunları Kombine antiretroviral tedavi alan bazı yetişkin HIV hastalarında osteonekroz (kemiğe kan gitmemesi nedeniyle kemik dokusunun ölümü) adı verilen bir kemik hastalığı gelişebilir. Kombinasyon antiretroviral tedavisinin süresi, kortikosteroid kullanımı, alkol tüketimi, diğerlerinin yanı sıra şiddetli immünosupresyon, daha yüksek vücut kitle indeksi, bu hastalığın gelişimi için sayısız risk faktöründen bazıları olabilir. Osteonekroz belirtileri eklem sertliği, ağrılar ve ağrılar (özellikle kalçalarda, dizlerde ve omuzlarda) ve hareket etmede zorluktur. Bu belirtilerden herhangi birini fark ederseniz doktorunuzla iletişime geçin.
Böbreklerin tübüler hücrelerine verilen hasar nedeniyle kemik sorunları (bazen kırıklarla sonuçlanan) da ortaya çıkabilir (bkz. bölüm 4, Olası yan etkiler).
- Çocuğunuzda hepatit de dahil olmak üzere karaciğer sorunları olup olmadığını doktorunuza söyleyin.Kronik hepatit B veya C dahil olmak üzere karaciğer sorunları olan ve antiretrovirallerle tedavi edilen hastalarda ciddi karaciğer komplikasyonları riski daha yüksektir ve potansiyel olarak ölümcüldür. Çocuğun hepatit B'si varsa, doktor onun için en iyi tedavi rejimini dikkatlice değerlendirecektir. Çocuğun karaciğer hastalığı veya kronik hepatit B'si varsa, doktor karaciğer fonksiyonunu izlemek için kan testleri isteyebilir.
- Enfeksiyonlara dikkat edin. Çocuğunuzda ilerlemiş HIV (AIDS) varsa ve bir "enfeksiyon" varsa, Viread ile tedaviye başladığında enfeksiyon ve iltihaplanma veya mevcut bir enfeksiyonun semptomlarında kötüleşme belirtileri geliştirebilir. Bu belirtiler vücudun bağışıklık sisteminin zayıfladığını gösterebilir. enfeksiyonla savaşıyor. Çocuğunuz Viread almaya başladıktan hemen sonra iltihap veya enfeksiyon belirtileri olup olmadığını kontrol edin. Herhangi bir iltihap veya enfeksiyon belirtisi fark ederseniz, hemen doktorunuza bildirin.
Fırsatçı enfeksiyonlara ek olarak, otoimmün bozukluklar (bağışıklık sistemi sağlıklı vücut dokusuna saldırdığında ortaya çıkan bir durum), çocuk HIV enfeksiyonunu tedavi etmek için ilaç almaya başladıktan sonra da ortaya çıkabilir. Tedaviye başladıktan aylar sonra otoimmün rahatsızlıklar ortaya çıkabilir.Çocuğunuzda kas güçsüzlüğü, gövdeye çıkan el ve ayaklarda başlangıçta güçsüzlük, çarpıntı, titreme veya hiperaktivite, derhal doktorunuza söyleyiniz ve gerekli tedaviyi talep ediniz.
Çocuklar ve ergenler
Viread 163 mg tabletler sadece aşağıdakiler için endikedir:
- 6 yaşından 12 yaşına kadar olan çocuklar
- vücut ağırlığı 22 kg ile 28 kg'dan az olanlar
- Direnç gelişmesi nedeniyle artık tam olarak etkili olmayan veya yan etkilere neden olan başka HIV ilaçları ile tedavi görmüş olanlar.
Viread 163 mg tabletler aşağıdaki kategoriler için endike değildir:
- Vücut ağırlığı 22 kg'dan az veya 28 kg'a eşit veya daha büyük olan çocuklarda endike değildir. Çocuğunuzun ağırlığı izin verilen sınırların dışındaysa doktorunuzla iletişime geçin.
- 6 yaşından küçük veya 12 yaşından büyük çocuklar ve ergenler için endike değildir.
- Her yaşta HBV (hepatit B virüsü) ile enfekte olan çocuk ve ergenlerde endike değildir.
Pozoloji için bkz. bölüm 3, Viread nasıl alınır.
Etkileşimler Hangi ilaçlar veya yiyecekler Viread'in etkisini değiştirebilir
Çocuğunuz başka ilaçlar alıyorsa, yakın zamanda aldıysa veya alma olasılığı varsa doktorunuza veya eczacınıza söyleyiniz.
- Çocuğunuz halihazırda tenofovir disoproksil fumarat veya tenofovir alafenamid içeren başka ilaçlar alıyorsa, Viread'i vermemelisiniz. Viread'i adefovir dipivoksil (kronik hepatit B tedavisinde kullanılan bir ilaç) içeren ilaçlarla birlikte vermeyin.
- Çocuğun böbreklere zarar verebilecek başka ilaçlar alıp almadığını doktora söylemek özellikle önemlidir. Bunlar şunları içerir:
- aminoglikozitler, pentamidin veya vankomisin (bakteriyel enfeksiyon için)
- amfoterisin B (mantar enfeksiyonu için)
- foscarnet, gansiklovir veya cidofovir (viral enfeksiyon için)
- interlökin-2 (kanser tedavisi için)
- adefovir dipivoksil (HBV için)
- takrolimus (bağışıklık sistemini baskılamak için)
- steroid olmayan antienflamatuar ilaçlar (kemik veya kas ağrısını gidermek için kullanılan NSAID'ler)
- Didanosin içeren diğer ilaçlar (HIV enfeksiyonu için): Viread'in didanosin içeren diğer antiviral ilaçlarla birlikte alınması kandaki didanozin düzeylerini artırabilir ve CD4 hücre sayılarını azaltabilir. Tenofovir disoproksil fumarat ve didanosin içeren ilaçlar birlikte alındığında, bazen ölümle sonuçlanan pankreas iltihabı ve laktik asidoz (kanda aşırı laktik asit) ile ilgili nadir raporlar olmuştur. Doktor, çocuğu tenofovir ve didanosin ile kombinasyon halinde tedavi edip etmeme konusunda çok dikkatli düşünmelidir.
- Çocuğun bir 'hepatit C enfeksiyonunu tedavi etmek için ledipasvir / sofosbuvir alıp almadığını doktora söylemek de önemlidir.
Yiyecek ve içecek ile birlikte
Viread yemekle birlikte verilmelidir (örneğin bir yemek veya atıştırmalık).
Uyarılar Şunları bilmek önemlidir:
Hamilelik ve emzirme
Hamileyseniz, bebek hamile olduğunuzu düşünüyorsa veya emziriyorsanız bu ilacı vermeden önce doktorunuza veya eczacınıza danışınız.
- Çocuk, doktorla özel olarak tartışılmadıkça hamilelik sırasında Viread almamalıdır. Viread'in hamile kadınlarda kullanımına ilişkin sınırlı klinik veri olmasına rağmen, genellikle kesinlikle gerekli olmadıkça kullanılmaz.
- Çocuk, Viread ile tedavi edilirken hamile kalmaktan kaçınmaya çalışmalıdır. Cinsel olarak aktifseniz, hamileliği önlemek için etkili doğum kontrolü kullanmalısınız.
- Bebeğiniz hamile kalırsa, doktorunuza antiretroviral tedavinin sizin ve bebeğiniz için olası yararlarını ve risklerini sorun.
- Bebek hamilelik sırasında zaten Viread aldıysa, doktor bebeğin gelişimini izlemek için düzenli olarak kan testleri ve diğer tanı testleri isteyebilir. Anneleri hamilelik sırasında Viread (NRTI) gibi ilaçlar alan bebeklerde virüse karşı korumanın yararı, yan etki riskinden daha ağır basmıştır.
- Viread tedavisi sırasında kız çocuğu emzirmemelidir. Bunun nedeni, bu ilacın etken maddesinin anne sütüne geçmesidir.
- Virüsleri bebeğe süt yoluyla bulaştırmamak için bebek emzirmemelidir.
Araç ve makine kullanma
Viread baş dönmesine neden olabilir. Viread kullanırken baş dönmesi oluşursa, çocuğunuz araba veya bisiklete binmemeli ve herhangi bir alet veya makine kullanmamalıdır.
Viread laktoz içerir
Çocuğunuzun laktoz veya diğer şekerlere karşı intoleransı varsa, Viread'i vermeden önce doktorunuza söyleyiniz.
Doz, Yöntem ve Uygulama Süresi Viread Nasıl Kullanılır: Pozoloji
Çocuğunuz bu ilacı her zaman tam olarak doktorunuzun veya eczacınızın size söylediği şekilde almalıdır. Şüpheniz varsa, doktorunuza veya eczacınıza danışın.
Önerilen doz:
- vücut ağırlığı 22 kg ile 28 kg'ın altında olan 6 ila 12 yaş arası çocuklar: Her gün yemekle birlikte (örneğin, yemek veya atıştırmalık) 1 tablet alınır.
Doktor bebeğin ağırlığını kontrol edecektir.
Çocuk her zaman doktorun önerdiği dozu almalıdır. Bu, ilaçların tamamen etkili olduğundan emin olmak ve tedaviye direnç geliştirme riskini azaltmak içindir. Doktorunuz size söylemediği sürece dozunuzu değiştirmeyin.
Doktorunuz Viread'i diğer antiretroviral ilaçlarla birlikte reçete edecektir.
Bu ilaçları alma konusunda rehberlik için diğer antiretrovirallerin paket broşürlerine bakın.
Çocuğunuz Viread'i almayı unutursa
Bir doz Viread'i kaçırmamanız önemlidir. Çocuğunuz bir dozu almayı unutursa, bu dozu kaçırmanızın üzerinden ne kadar zaman geçtiğini hesaplayın.
- Normal alım zamanından sonra 12 saatten az bir süre geçtiyse, çocuk ilacı mümkün olan en kısa sürede almalı ve ardından bir sonraki dozu planlanan zamanda almalıdır.
- Normal alım süresinin üzerinden 12 saatten fazla zaman geçmişse, çocuk unutulan dozu almamalıdır.Bekleyin ve bir sonraki dozu düzenli olarak alın.Unutulan bir tableti telafi etmek için çift doz vermeyin.
Viread'i aldıktan sonraki 1 saat içinde kusma olursa, çocuğa bir tablet daha verin. Çocuk, Viread'i aldıktan sonra "bir saatten fazla kustuysa tablet" almamalıdır.
Çocuğunuz Viread almayı bırakırsa
Çocuğunuz, doktorunuza danışmadan VIREAD almayı bırakmamalıdır.Viread'i durdurmak, doktorunuz tarafından reçete edilen tedavinin etkinliğini azaltabilir.
Çocuğunuzda HIV enfeksiyonu ve hepatit B varsa, önce doktorunuza danışmadan Viread tedavisini durdurmamanız özellikle önemlidir.Bazı hastalarda semptomlar veya kan testlerinin gösterdiği gibi hepatitlerinde kötüleşme görülmüştür. Tedaviyi bıraktıktan birkaç ay sonra. İlerlemiş karaciğer hastalığı veya sirozu olan hastalarda, bazı hastalarda hepatitin kötüleşmesine yol açabileceğinden tedavinin kesilmesi önerilmez.
- Çocuğunuz herhangi bir nedenle, özellikle de bir yan etki yaşadıysa veya başka bir hastalığı varsa, Viread almayı bırakmadan önce doktorunuzla konuşun.
- Tedaviyi bıraktıktan sonra gözlemlenen yeni veya olağandışı semptomları, özellikle de normalde hepatit B enfeksiyonu ile ilişkili semptomları derhal doktorunuza bildirin.
- Çocuğunuz tekrar Viread tabletleri almaya başlamadan önce doktorunuzla iletişime geçin.
Bu ilacın kullanımıyla ilgili başka sorularınız varsa, doktorunuza veya eczacınıza sorunuz.
Aşırı doz Çok fazla Viread aldıysanız ne yapmalısınız?
Çocuğunuz yanlışlıkla çok fazla Viread tableti alırsa, bu ilacın olası yan etkilerinin gelişme riskini artırabilir (bkz. bölüm 4, Olası yan etkiler). Doktorunuza veya en yakın acil servise başvurunuz. Çocuğunuzun ne aldığını kolayca tanımlayabilmeniz için tablet şişesini yanınıza alın.
Yan Etkiler Viread'in yan etkileri nelerdir?
HIV tedavisi sırasında kiloda ve kan lipid ve glikoz seviyelerinde bir artış olabilir.Bu kısmen sağlığın ve yaşam tarzının iyileşmesiyle ve kan lipidleri durumunda bazen HIV'e karşı aynı ilaçlarla bağlantılıdır. Doktor çocuğu bu değişiklikler için kontrol edecektir.
Tüm ilaçlar gibi, bu ilaç da yan etkilere neden olabilir, ancak bu yan etkiler herkeste görülmez.
Muhtemel ciddi yan etkiler: Derhal doktorunuza söyleyiniz.
- Laktik asidoz (kanda laktik asit fazlalığı) nadir görülen (1000 kişiden 1'ini etkileyebilir) ancak ölümcül olabilen ciddi bir yan etkidir.Aşağıdaki yan etkiler laktik asidozun belirtileri olabilir:
- derin ve hızlı nefes alma
- uyuşukluk
- mide bulantısı, kusma ve mide ağrısı
Çocuğunuzda laktik asidoz olduğunu düşünüyorsanız hemen doktorunuza başvurunuz.
Diğer olası ciddi yan etkiler
Aşağıdaki yan etkiler yaygın değildir (tedavi edilen her 100 hastadan 1'ini etkiler):
- pankreas iltihabının neden olduğu karın (karın) ağrısı
- böbreklerdeki belirli hücrelerde hasar (tübüler hücreler)
Aşağıdaki yan etkiler nadirdir (tedavi edilen her 1000 hastadan 1'ini etkiler):
- böbrek iltihabı, ağır idrar ve susuzluk
- böbrek yetmezliği dahil böbrek problemlerinin neden olduğu idrar ve sırt ağrısı değişiklikleri
- böbrek tübüler hücrelerine verilen hasardan kaynaklanabilen kemiklerin yumuşaması (kemik ağrısı ve bazen kırıklarla birlikte)
- yağlı karaciğer
Çocuğunuzda bu ciddi yan etkilerden herhangi birinin olduğunu düşünüyorsanız, lütfen doktorunuza başvurunuz.
Daha sık yan etkiler
Aşağıdaki yan etkiler çok yaygındır (tedavi edilen her 100 hastadan en az 10'unda görülür):
- ishal, kusma, bulantı, baş dönmesi, döküntü, güçsüzlük hissi
Laboratuvar testleri ayrıca şunları gösterdi:
- kandaki fosfatın azalması
Diğer olası yan etkiler
Aşağıdaki yan etkiler yaygındır (tedavi edilen her 100 hastadan 10'unu etkiler):
- bağırsak gazı
Laboratuvar testleri ayrıca şunları gösterdi:
- karaciğer sorunları
Aşağıdaki yan etkiler yaygın değildir (tedavi edilen her 100 hastadan 1'ini etkiler):
- kas yıkımı, kas ağrısı veya kas zayıflığı
Laboratuvar testleri ayrıca şunları gösterdi:
- kandaki potasyumun azalması
- kan kreatinin artışı
- pankreas sorunları
Böbrek tübül hücrelerinin zarar görmesinden dolayı kasların parçalanması, kemiklerin yumuşaması (kemik ağrısı ve bazen kırıklarla birlikte), kas ağrısı, kas zayıflığı ve kanda potasyum veya fosfat azalması meydana gelebilir.
Aşağıdaki yan etkiler nadirdir (tedavi edilen her 1000 hastadan 1'ini etkiler):
- karaciğer iltihabının neden olduğu karın (karın) ağrısı
- yüz, dudaklar, dil veya boğazın şişmesi
Yan etkilerin raporlanması
Herhangi bir yan etki yaşarsanız, doktorunuzla veya eczacınızla konuşun.Bu kullanma talimatında listelenmeyen olası yan etkiler de buna dahildir. Yan etkileri doğrudan Ek V'te listelenen ulusal raporlama sistemi aracılığıyla da bildirebilirsiniz. Yan etkileri bildirerek bu ilacın güvenliği hakkında daha fazla bilgi sağlanmasına yardımcı olabilirsiniz.
Son Kullanma ve Saklama
Bu ilacı çocukların göremeyeceği ve erişemeyeceği bir yerde saklayın.
Bu ilacı, şişe ve karton üzerinde belirtilen son kullanma tarihinden {EXP} sonra kullanmayınız. Son kullanma tarihi, o ayın son gününü ifade eder.
Bu ilaç herhangi bir özel saklama koşulu gerektirmez.
Herhangi bir ilacı atık su veya evsel atık yoluyla atmayın.Artık kullanmadığınız ilaçları nasıl atacağınızı eczacınıza sorun.Bu, çevrenin korunmasına yardımcı olacaktır.
Diğer bilgiler
Viread'in içeriği
- Aktif madde tenofovirdir. Her bir Viread tableti, 163 mg tenofovir disoproksil (fumarat olarak) içerir.
- Diğer bileşenler, tablet çekirdeğini oluşturan mikrokristal selüloz (E460), önceden jelatinleştirilmiş nişasta, kroskarmeloz sodyum, laktoz monohidrat ve magnezyum stearat (E572) ve laktoz monohidrat, hipromelloz (E464), titanyum dioksit (E171) ve gliserol triasetattır (E1518). ) tablet kaplamasını oluşturan. Bkz. bölüm 2 "Viread laktoz içerir".
Viread'in görünümü ve paketin içeriği
Viread 163 mg film kaplı tabletler beyaz, yuvarlak şekilli, 10.7 mm çapında, bir tarafında "GSI" ve diğer tarafında "200" baskısı olan film kaplı tabletlerdir. 30 tablet Her şişe, tabletleri korumak için şişede saklanması gereken, kurutucu olarak silika jel içerir.Silika jel bir poşet veya kavanozda bulunur.Ayrık ve yutulmamalıdır.
Aşağıdaki ambalaj boyutları mevcuttur: 1 şişe 30 film kaplı tablet ve 3 şişe 30 film kaplı tablet içeren dış karton. Tüm paket boyutları pazarlanmayabilir.
Kaynak Paket Broşürü: AIFA (İtalyan İlaç Ajansı). Ocak 2016'da yayınlanan içerik. Mevcut bilgiler güncel olmayabilir.
En güncel sürüme erişmek için AIFA (İtalyan İlaç Ajansı) web sitesine erişmeniz önerilir. Sorumluluk reddi ve faydalı bilgiler.
01.0 TIBBİ ÜRÜNÜN ADI
FİLM KAPLI VIREAD 163 MG TABLETLER
02.0 KALİTATİF VE KANTİTATİF BİLEŞİM
Her film kaplı tablet, 163 mg tenofovir disoproksil (fumarat olarak) içerir.
Bilinen etkileri olan yardımcı madde: Her tablet 109 mg laktoz (monohidrat olarak) içerir.
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakın.
03.0 FARMASÖTİK FORM
Film kaplı tablet (tablet).
Bir yüzünde "GILEAD" ve diğer yüzünde "200" baskısı bulunan, 10.7 mm çapında, yuvarlak şekilli, beyaz film kaplı tabletler.
04.0 KLİNİK BİLGİLER
04.1 Terapötik endikasyonlar
Viread 163 mg film kaplı tabletler, diğer antiretroviral tıbbi ürünlerle kombinasyon halinde, HIV-1 ile enfekte, NRTI dirençli, 6 ila 22 kg ila 28 kg vücut ağırlığının altındaki pediatrik hastaların tedavisinde endikedir. hat tıbbi ürünler toksik etkiler gösterir.
Daha önce antiretroviral tedavi deneyimi olan HIV-1 ile enfekte hastaları tedavi etmek için Viread kullanma seçimi, bireysel viral direnç testlerinin ve/veya önceki tedavilerin sonuçlarına dayanmalıdır.
04.2 Pozoloji ve uygulama yöntemi
Tedavi, HIV enfeksiyonunun yönetiminde deneyimli bir doktor tarafından başlatılmalıdır.
Dozaj
6 yaşındaki HIV-1 ile enfekte pediyatrik hastaların film kaplı tabletleri yutması için önerilen doz, yemekle birlikte ağızdan alınan günde bir kez 163 mg tablettir.
6 ila 6 yaş arası HIV-1 ile enfekte pediatrik hastaların tedavisi için Viread 123 mg ve 204 mg film kaplı tabletlerin Kısa Ürün Bilgisine bakın.
Viread, 2 ila 2 yaş arasındaki HIV-1 ile enfekte pediatrik hastalar için 33 mg/g granül olarak da mevcuttur.
Kaçırılan doz
Hasta, normal dozlama zamanından sonraki 12 saat içinde bir Viread dozunu almayı unutursa, Viread'i mümkün olan en kısa sürede, yemekle birlikte almalı ve normal doz programına devam etmelidir. Saatler ve bir sonraki dozunuzun zamanı neredeyse geldi, kaçırdığınız dozu almamalı ve normal doz programınıza devam etmelisiniz.
Hasta, Viread aldıktan sonraki 1 saat içinde kusarsa, başka bir tablet almalıdır. Hasta, Viread aldıktan sonra 1 saatten fazla kusarsa, başka bir doz almasına gerek yoktur.
Özel popülasyonlar
Böbrek yetmezliği
Renal bozukluğu olan pediyatrik hastalarda tenofovir disoproksil fumarat kullanımı önerilmez (bkz. bölüm 4.4).
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir (bkz. bölüm 4.4 ve 5.2).
HIV ve hepatit B virüsü (HBV) ile ko-enfekte hastalarda Viread 163 mg film kaplı tablet tedavisi kesilirse, bu tür hastalar hepatit alevlenmeleri açısından yakından izlenmelidir (bkz. bölüm 4.4).
Pediatrik popülasyon
2 yaşın altındaki HIV-1 ile enfekte çocuklarda tenofovir disoproksil fumaratın güvenliği ve etkinliği belirlenmemiştir.Veri mevcut değildir.
2 ila 2 yaş arası kronik hepatit B'li çocuklarda tenofovir disoproksil fumaratın güvenliği ve etkinliği
Uygulama yöntemi
Viread 163 mg film kaplı tabletler günde bir kez yemekle birlikte ağızdan alınmalıdır.
04.3 Kontrendikasyonlar
Etkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık.
04.4 Özel uyarılar ve uygun kullanım önlemleri
Genel olarak
Antiretroviral tedavi ile etkili viral baskılamanın cinsel bulaşma riskini önemli ölçüde azalttığı gösterilmiş olsa da, artık bir risk göz ardı edilemez. Ulusal yönergelere uygun olarak bulaşmayı önlemek için önlemler alınmalıdır.
Diğer tıbbi ürünlerle birlikte uygulama
- Viread, tenofovir disoproksil fumarat içeren diğer tıbbi ürünlerle birlikte uygulanmamalıdır.
- Viread, adefovir dipivoksil ile birlikte uygulanmamalıdır.
- Tenofovir disoproksil fumarat ve didanosinin birlikte uygulanması önerilmez. Tenofovir disoproksil fumarat ve didanozinin birlikte uygulanması, didanosine sistemik maruziyette %40-60'lık bir artışa neden oldu ve bu da didanosine bağlı advers reaksiyon riskini artırabilir (bkz. Bölüm 4.5). Nadiren pankreatit ve asidoz bildirilmiştir. ölümcül. Tenofovir disoproksil fumarat ve didanosinin günlük 400 mg dozda birlikte uygulanması, muhtemelen "fosforile edilmiş didanosin (aktif ) düzeylerini artıran bir "hücre içi etkileşim" nedeniyle CD4 hücre sayısında önemli bir azalma ile ilişkilendirilmiştir. Tenofovir disoproksil fumarat ile birlikte uygulanan didanosin dozunun 250 mg'a düşürülmesi, HIV-1 enfeksiyonunun tedavisi için test edilen birçok kombinasyonda "yüksek oranda virolojik başarısızlık" ile ilişkilendirilmiştir.
Nükleositler / nükleotitler ile üçlü tedavi
Tenofovir disoproksil fumarat, HIV hastalarına lamivudin ve abakavir ile birlikte lamivudin ve didanosin ile günde bir kez rejimlerde kombinasyon halinde uygulandığında, "yüksek oranda virolojik başarısızlık ve erken direnç başlangıcı gözlenmiştir. .
Yetişkin popülasyonda böbrek ve kemik etkileri
Böbrek üzerindeki etkiler
Tenofovir esas olarak böbrekler tarafından elimine edilir. Klinik uygulamada tenofovir disoproksil fumarat kullanımıyla böbrek yetmezliği, böbrek yetmezliği, kreatinin yükselmesi, hipofosfatemi ve proksimal tübülopati (Fanconi sendromu dahil) vakaları bildirilmiştir (bkz. bölüm 4.8).
Böbrek yetmezliği
Tenofovir ile böbrek güvenliği, böbrek fonksiyon bozukluğu (kreatinin klerensi) olan yetişkin hastalarda çok sınırlı ölçüde incelenmiştir.
Kemik seviyesindeki etkiler
144 hafta boyunca yürütülen kontrollü bir klinik çalışmada, tenofovir disoproksil fumaratın lamivudin ve efavirenz ile kombinasyon halinde stavudin ile karşılaştırıldığı HIV ile enfekte hastalarda, önceden antiretrovirallerle tedavi edilmemiş yetişkin hastalarda kemik mineral yoğunluğunda hafif düşüşler gözlenmiştir.kemik mineral yoğunluğu, BMD) tenofovir disoproksil fumarat grubunda 144. haftada omurgada BMD'deki düşüşler ve kemik biyo-belirteçlerinde başlangıca göre değişiklikler anlamlı olarak daha yüksekti. 96. haftaya kadar. Bununla birlikte, 144 haftalık tedaviden sonra kırık riskini veya önemli kemik anormalliklerinin kanıtlarını artırmaz.
Kemik anormallikleri (nadiren kırıklara yol açar) proksimal renal tübülopati ile ilişkili olabilir (bkz. bölüm 4.8).
Pediatrik popülasyonda böbrek ve kemik etkileri
Kemik ve böbrek toksisitesinin uzun vadeli etkileri kesin olarak bilinmemektedir. Ayrıca renal toksisitenin tersine çevrilebilirliğini tam olarak belirlemek de mümkün değildir. Bu nedenle, tedavinin yarar/risk oranını vaka bazında yeterince değerlendirmek, tedavi sırasında (tedaviyi bırakma kararı dahil) uygun izlemeye karar vermek ve ilavelere olan ihtiyacı değerlendirmek için multidisipliner bir yaklaşım tavsiye edilir.
Böbrek üzerindeki etkiler
Proksimal renal tübülopati ile uyumlu renal advers reaksiyonlar, 2 ila 2 yaş arasındaki HIV-1 ile enfekte pediatrik hastalarda GS-US-104-0352 klinik çalışmasında rapor edilmiştir.
Böbrek fonksiyonunun izlenmesi
Tenofovir disoproksil fumarat ile tedaviye başlamadan önce tüm hastalarda böbrek fonksiyonunun (kreatinin klerensi ve serum fosfat) değerlendirilmesi ve tedaviden iki ila dört hafta sonra, üç aylık tedaviden sonra ve daha sonra her üç ila altı kez izlenmesi önerilir. aylar böbrek yetmezliği riski olan hastalarda böbrek fonksiyonunun daha sık izlenmesi gerekir.
Böbrek fonksiyonunun yönetimi
Doğrulanmış serum fosfat konsantrasyonları durumunda kan glukozu ve idrarda potasyum ve glukoz (bkz. bölüm 4.8, proksimal tübülopati). Renal anormalliklerden şüpheleniliyor veya tespit ediliyorsa, tenofovir disoproksil fumarat ile tedavinin olası kesilmesini değerlendirmek için nefrolojik konsültasyon istenmelidir. Tenofovir disoproksil fumarat tedavisinin kesilmesi, başka bir neden belirlenmemişse, böbrek fonksiyonunda ilerleyici düşüş olması durumunda da düşünülmelidir.
Birlikte uygulama ve renal toksisite riski
Hasta tedavi ediliyorsa veya yakın zamanda nefrotoksik tıbbi ürünler (örneğin aminoglikozitler, amfoterisin B, foskarnet, gansiklovir, pentamidin, vankomisin, sidofovir veya interlökin-2) alıyorsa tenofovir disoproksil fumarat kullanımından kaçınılmalıdır. fumarat ve nefrotoksik ajanlardan kaçınılamaz, böbrek fonksiyonu haftalık olarak izlenmelidir.
Çoklu veya yüksek doz nonsteroidal antiinflamatuar ilaçların (NSAID'ler) başlatılmasından sonra, tenofovir disoproksil fumarat ile tedavi edilen ve böbrek fonksiyon bozukluğu için risk faktörleri olan hastalarda akut böbrek yetmezliği vakaları bildirilmiştir. Bir NSAID için böbrek fonksiyonu yeterince izlenmelidir.
Bir ritonavir veya kobisistat destekli proteaz inhibitörü ile kombinasyon halinde tenofovir disoproksil fumarat alan hastalarda böbrek yetmezliği riskinin daha yüksek olduğu bildirilmiştir. Bu hastalarda böbrek fonksiyonunun dikkatli bir şekilde izlenmesi gereklidir (bkz. bölüm 4.5). Renal risk faktörleri olan hastalarda, tenofovir disoproksil fumarat ile güçlendirilmiş bir proteaz inhibitörünün birlikte uygulanması dikkatle düşünülmelidir.
Tenofovir disoproksil fumaratın klinik değerlendirmesi, proteinlerin insan organik anyon taşıyıcısı 1 ve 3 yoluyla taşınması dahil, aynı böbrek yolu ile salgılanan tıbbi ürünlerle tedavi edilen hastalarda yapılmamıştır (insan organik anyon taşıyıcısı - hOAT) veya MRP 4 (örneğin cidofovir, nefrotoksik özellikleri bilinen bir ilaç). Bu renal protein taşıyıcıları, tübüler sekresyondan ve kısmen tenofovir ve sidofovirin renal eliminasyonundan sorumlu olabilir Sonuç olarak, hOAT protein taşıyıcıları 1 ve 3 veya MRP 4 dahil olmak üzere aynı renal yoldan salgılanan bu tıbbi ürünlerin farmakokinetiği , kombinasyon halinde uygulandıklarında değiştirilebilirler.Kesinlikle gerekli olduğu durumlar dışında, aynı böbrek yolundan salgılanan bu ilaçların birlikte kullanımı önerilmez, ancak bu kullanım kaçınılmazsa böbrek fonksiyonu izlenmelidir. haftalık (bkz. bölüm 4.5).
Böbrek yetmezliği
Böbrek yetmezliği olan pediyatrik hastalarda tenofovir disoproksil fumarat kullanımı önerilmemektedir (bkz. Bölüm 4.2). fumarat.
Kemik seviyesindeki etkiler
Viread, BMD'nin azalmasına neden olabilir. BMD'deki tenofovir disoproksil fumarat ile ilişkili değişikliklerin uzun vadeli kemik durumu ve gelecekteki kırık riski üzerindeki etkileri henüz bilinmemektedir (bkz. bölüm 5.1).
Pediatrik hastalarda kemik anormallikleri tespit edilir veya şüphelenilirse endokrinolog ve/veya nefrolog ile konsültasyon istenmelidir.
HIV ve hepatit B veya C virüsü ile birlikte enfekte olan hastalar
Kronik hepatit B veya C'li ve antiretroviral tedavi alan hastalarda ciddi ve potansiyel olarak ölümcül hepatik advers reaksiyon riski artmıştır.
Hekimler, hepatit B virüsü (HBV) ile ko-enfekte hastalarda HIV enfeksiyonunun optimal yönetimi için mevcut HIV tedavi kılavuzlarına başvurmalıdır.
Hepatit B veya C için eşzamanlı antiviral tedavi olması durumunda, lütfen bu tıbbi ürünlerin Kısa Ürün Bilgisine de bakın.
HIV ve HBV koenfekte hastalarda Viread tedavisinin kesilmesi, hepatitin şiddetli akut alevlenmeleri ile ilişkili olabilir.HIV ve HBV ile ko-enfekte olan ve Viread tedavisini bırakan hastalar aşağıdakilerle yakından izlenmelidir: takip et Tedaviyi bıraktıktan sonra en az 6 ay süreyle hem klinik hem de laboratuvar olarak.İlerlemiş karaciğer hastalığı veya sirozu olan hastalarda, tedavi sonrası hepatit alevlenmesi hepatik dekompansasyona yol açabileceğinden, tedavinin kesilmesi önerilmez.
Karaciğer hastalığı
Tenofovir ve tenofovir disoproksil fumarat, karaciğer enzimleri tarafından metabolize edilmez. Çeşitli derecelerde karaciğer yetmezliği olan HIV ile enfekte olmayan yetişkin hastalarda bir farmakokinetik çalışma yapılmıştır. Bu hastalarda önemli farmakokinetik değişiklikler gözlenmemiştir (bkz. bölüm 5.2).
Kombinasyon antiretroviral tedavi sırasında kronik aktif hepatit dahil önceden karaciğer fonksiyon bozukluğu olan hastalar (kombinasyon antiretroviral tedavi, CART) karaciğer fonksiyon anormalliklerinin sıklığında bir artış gösterir ve genel klinik uygulamaya göre izlenmelidir. Bu hastalarda karaciğer hastalığında kötüleşme meydana gelirse, tedavinin kesilmesi veya kesilmesi düşünülmelidir.
lipodistrofi
CART, HIV'li hastalarda vücut yağının (lipodistrofi) yeniden dağılımı ile ilişkilendirilmiştir. Bu olayların uzun vadeli sonuçları şu anda bilinmemektedir. Mekanizma bilgisi eksik. Viseral lipomatozis ve proteaz inhibitörleri ve lipoatrofi ve nükleozid revers transkriptaz inhibitörleri arasında bir ilişki olduğu varsayılmıştır.Artan bir lipodistrofi riski, ileri yaş gibi bireysel faktörlerin varlığı ve daha uzun süreli kullanım gibi ilaca bağlı faktörler ile ilişkilendirilmiştir. antiretroviral tedavi ve ilişkili metabolik bozukluklar. Klinik muayene, yağın yeniden dağılımının fiziksel belirtilerinin değerlendirilmesini içermelidir Serum lipid ve açlık glukoz ölçümleri dikkate alınmalıdır Lipid metabolizması bozuklukları klinik olarak uygun şekilde tedavi edilmelidir (bkz. bölüm 4.8).
Tenofovir yapısal olarak nükleozid analoglarıyla ilişkili olduğundan, lipodistrofi riski göz ardı edilemez. Bununla birlikte, antiretrovirallerle önceden tedavi edilmemiş HIV ile enfekte yetişkin hastalarda 144 haftalık tedaviden elde edilen klinik veriler, lamivudin ve efavirenz ile birlikte uygulandığında stavudine kıyasla tenofovir disoproksil fumarat ile lipodistrofi riskinin daha düşük olduğunu göstermektedir.
mitokondriyal disfonksiyon
Kanıtlanmış ya canlıda o laboratuvar ortamındanükleosid ve nükleotid analogları, değişen seviyelerde mitokondriyal hasara neden olur. HIV negatif bebeklerde mitokondriyal disfonksiyon rapor edilmiştir. rahimde ve/veya doğumdan sonra nükleosit analoglarına. Bildirilen ana yan etkiler hematolojik bozukluklar (anemi, nötropeni), metabolik bozukluklar (hiperlaktatemi, hiperlipazemidir). Bu olaylar genellikle geçicidir. Bazı nörolojik bozukluklar (hipertoni, konvülsiyonlar, anormal davranışlar) geç dönemler olarak bildirilmiştir. Nörolojik bozuklukların geçici mi yoksa kalıcı mı olduğu şu anda bilinmemektedir. Maruz kalan herhangi bir çocuk için rahimde HIV negatif olsa bile, nükleosit veya nükleotid analoglarına takip et klinik ve laboratuvar ve ilgili belirti veya semptomların olması durumunda, olası mitokondriyal işlev bozukluklarını saptamak için tam bir muayene. Bu bulgular, HIV'in dikey geçişini önlemek için hamile kadınlarda antiretroviral tedavinin kullanımına ilişkin mevcut ulusal önerileri değiştirmez.
İmmün Reaktivasyon Sendromu
CART uygulaması sırasında ciddi bağışıklık yetmezliği olan HIV ile enfekte hastalarda, asemptomatik veya rezidüel fırsatçı patojenlere karşı inflamatuar bir reaksiyon ortaya çıkabilir ve ciddi klinik durumlara veya semptomların şiddetlenmesine neden olabilir. Tipik olarak, bu tür reaksiyonlar, CART'ın başlatılmasından sonraki ilk birkaç hafta veya ay içinde olmuştur.Bunun ilgili örnekleri sitomegalovirüs retiniti, jeneralize ve/veya fokal mikobakteriyel enfeksiyonlar ve Pneumocystis jirovecii. Herhangi bir inflamatuar semptom değerlendirilmeli ve gerekirse tedavi başlatılmalıdır.
Otoimmün bozuklukların (Graves hastalığı gibi) oluşumu, immün reaktivasyon bağlamında da rapor edilmiştir; bununla birlikte, kaydedilen başlangıç süresi daha değişkendir ve bu olaylar tedaviye başladıktan aylar sonra bile ortaya çıkabilir.
osteonekroz
Etiyoloji multifaktöriyel olarak kabul edilse de (kortikosteroid kullanımı, alkol tüketimi, şiddetli immünsüpresyon, daha yüksek vücut kitle indeksi dahil), osteonekroz vakaları esas olarak ilerlemiş HIV hastalığı olan hastalarda bildirilmiştir. eklem rahatsızlığı, ağrı ve sertlik veya harekette zorluk olması durumunda tıbbi yardım almanız tavsiye edilir.
Viread 163 mg film kaplı tabletler laktoz monohidrat içerir. Sonuç olarak, nadir kalıtsal galaktoz intoleransı, Lapp-laktaz eksikliği veya glukoz-galaktoz malabsorpsiyon sorunları olan hastalar bu ilacı almamalıdır.
04.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim biçimleri
Etkileşim çalışmaları sadece yetişkinlerde yapılmıştır.
Deneylerle elde edilen sonuçlara göre laboratuvar ortamında ve tenofovirin eliminasyon yoluna ilişkin bilinen verilere göre, tenofovir ve diğer tıbbi ürünler arasında CYP450 aracılı etkileşim potansiyeli düşüktür.
Eşzamanlı tedaviler önerilmez
Viread, tenofovir disoproksil fumarat içeren diğer tıbbi ürünlerle birlikte uygulanmamalıdır.
Viread, adefovir dipivoksil ile birlikte uygulanmamalıdır.
didanosin
Tenofovir disoproksil fumarat ve didanosinin birlikte uygulanması önerilmez (bkz. bölüm 4.4 ve Tablo 1).
Böbrek tarafından atılan tıbbi ürünler
Tenofovir esas olarak böbrekler tarafından elimine edildiğinden, tenofovir disoproksil fumaratın böbrek fonksiyonunu azaltan veya protein taşıyıcı hOAT 1, hOAT 3 veya MRP 4 (örn. tenofovir ve/veya birlikte uygulanan diğer tıbbi ürünler.
Tenofovir disoproksil fumarat kullanımı, nefrotoksik tıbbi ürünlerle birlikte veya yakın zamanda kullanımda kaçınılmalıdır. Bazı örnekler bunlarla sınırlı olmamak üzere aminoglikozitler, amfoterisin B, foskarnet, gansiklovir, pentamidin, vankomisin, sidofovir veya interlökin-2'yi içerir (bkz. bölüm 4.4).
Takrolimus böbrek fonksiyonunu etkileyebileceğinden, tenofovir disoproksil fumarat ile birlikte uygulandığında yakın takip önerilir.
Diğer etkileşimler
Tenofovir disoproksil fumarat ile proteaz inhibitörleri ve proteaz inhibitörleri dışındaki antiretroviraller arasındaki etkileşimler, aşağıdaki Tablo 1'de gösterilmiştir ("artış" ↑ ", azalma "? " olarak belirtilmiştir, Değişiklik yok" ↔ " olarak, günde iki kez "bid" olarak gösterilmiştir. , günde bir kez "qd" olarak).
Tablo 1: Tenofovir disoproksil fumarat ile diğer tıbbi ürünler arasındaki etkileşimler
Diğer ilaçlarla yapılan çalışmalar
Tenofovir disoproksil fumarat, emtrisitabin, lamivudin, indinavir, efavirenz, nelfinavir, sakinavir (ritonavir ile güçlendirilmiş), metadon, ribavirin, rifestampisin, kontraseptif veya hormonal ile birlikte uygulandığında klinik olarak anlamlı farmakokinetik etkileşimler olmamıştır.
Tenofovir disoproksil fumarat, yiyecekler tenofovirin biyoyararlanımını arttırdığı için yiyeceklerle birlikte alınmalıdır (bkz. bölüm 5.2).
04.6 Hamilelik ve emzirme
Gebelik
Gebe kadınlarda (300 ila 1.000 gebelik arasında) orta düzeyde veri, tenofovir disoproksil fumarat ile ilişkili herhangi bir malformasyon veya fetal/neonatal toksisite olmadığını göstermektedir. Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesi göstermemiştir (bkz. bölüm 5.3). Gerekirse, hamilelik sırasında tenofovir disoproksil fumarat kullanımı düşünülebilir.
Besleme zamanı
Tenofovir'in insan sütüne geçtiği gösterilmiştir. Tenofovirin yeni doğanlar/bebekler üzerindeki etkileri hakkında yeterli bilgi bulunmamaktadır. Bu nedenle Viread emzirme döneminde kullanılmamalıdır.
Genel bir kural olarak, HIV virüsünün bebeğe bulaşmasını önlemek için HIV bulaşmış kadınların bebeklerini emzirmemeleri önerilir.
Doğurganlık
Tenofovir disoproksil fumaratın doğurganlık üzerindeki etkisine ilişkin klinik veriler sınırlıdır Hayvan çalışmaları, tenofovir disoproksil fumaratın doğurganlık üzerindeki zararlı etkilerini göstermemektedir.
04.7 Araç ve makine kullanma yeteneği üzerindeki etkiler
Araç ve makine kullanımı ile ilgili herhangi bir çalışma yapılmamıştır, ancak hastalara tenofovir disoproksil fumarat tedavisi sırasında baş dönmesi gözlemlendiği söylenmelidir.
04.8 İstenmeyen etkiler
Güvenlik profilinin özeti
Tenofovir disoproksil fumarat alan hastalarda, bazen kemik değişikliklerine (ve nadiren kırıklara) yol açan nadir olaylar, böbrek yetmezliği, böbrek yetmezliği ve proksimal renal tübülopati (Fanconi sendromu dahil) bildirilmiştir. Viread alan hastalarda böbrek fonksiyonunun izlenmesi önerilir (bkz. bölüm 4.4).
Diğer antiretroviral ajanlarla kombinasyon halinde tenofovir disoproksil fumarat tedavisini takiben hastaların yaklaşık üçte birinin advers reaksiyonlar yaşaması beklenebilir. Bu reaksiyonlar genellikle hafif veya orta dereceli gastrointestinal ataklardan oluşur.
Tenofovir disoproksil fumarat ile tedavi edilen yetişkin hastaların yaklaşık %1'i, gastrointestinal etkiler nedeniyle tedaviyi bırakmıştır.
Lipodistrofi, tenofovir disoproksil fumarat ile ilişkilidir (bkz. bölüm 4.4 ve 4.8). Seçilmiş advers reaksiyonların tanımı).
Advers reaksiyon riskinde artışa yol açabileceğinden, Viread ve didanosinin birlikte uygulanması önerilmez (bkz. Bölüm 4.5).Nadiren pankreatit ve bazen ölümcül olabilen laktik asidoz bildirilmiştir (bkz. bölüm 4.4).
HIV ve HBV koenfekte hastalarda Viread tedavisinin kesilmesi, hepatitin şiddetli akut alevlenmeleri ile ilişkili olabilir (bkz. bölüm 4.4).
Advers reaksiyonların özet tablosu
Tenofovir disoproksil fumarat için advers reaksiyonların değerlendirilmesi, klinik çalışmalardan ve pazarlama sonrası deneyimlerden elde edilen güvenlik verilerine dayanmaktadır.Tüm advers reaksiyonlar Tablo 2'de gösterilmektedir.
HIV-1 klinik çalışmalarından elde edilen advers reaksiyonların değerlendirilmesi, daha önce tedavi deneyimi olan 653 yetişkin hastanın diğer ilaçlarla kombinasyon halinde tenofovir disoproksil fumarat (n = 443) veya plasebo (n = 210) ile tedavi edildiği iki çalışmanın deneyimine dayanmaktadır. 24 haftalık antiretroviral tıbbi ürünlerin yanı sıra, önceden tedavi görmemiş 600 yetişkin hastanın, tenofovir disoproksil 245 mg (fumarat olarak) (n = 299) veya stavudin (n = 301) ile tedavi edildiği çift kör kontrollü karşılaştırmalı bir çalışma. 144 hafta boyunca lamivudin ve efavirenz ile kombinasyon.
Tedavi ile şüpheli (veya en azından olası) bir korelasyonu olan advers reaksiyonlar, sistem organ sınıfına ve sıklığa göre bölünmüş olarak aşağıda listelenmiştir. Her bir sıklık sınıfı içinde, advers reaksiyonlar azalan şiddet sırasına göre listelenmiştir Sıklıklar çok yaygın (≥ 1/10), yaygın (≥ 1/100,
Tablo 2: Klinik çalışmalara ve pazarlama sonrası deneyime dayalı olarak tenofovir disoproksil fumarat ile ilişkili advers reaksiyonların özet tablosu
1 Bu advers reaksiyon, proksimal renal tübülopatinin bir sonucu olarak ortaya çıkabilir. Bu durumun yokluğunda tenofovir disoproksil fumarat ile ilişkili olduğu düşünülmez.
2 Bu advers reaksiyon, pazarlama sonrası sürveyans yoluyla belirlendi, ancak tenofovir disoproksil fumarat ile randomize kontrollü klinik çalışmalarda veya genişletilmiş erişim programlarında gözlenmedi. Sıklık, randomize kontrollü çalışmalarda ve genişletilmiş erişim programlarında (n = 7319) tenofovir disoproksil fumarata maruz kalan toplam hasta sayısına dayalı bir istatistiksel hesaplama ile değerlendirildi.
Seçilmiş advers reaksiyonların tanımı
Böbrek yetmezliği
Viread böbrek hasarına neden olabileceğinden böbrek fonksiyonunun izlenmesi önerilir (bkz. bölüm 4.4 ve 4.8). Güvenlik profilinin özeti). Proksimal renal tübülopati, tenofovir disoproksil fumarat tedavisinin kesilmesinin ardından genellikle düzeldi veya düzeldi. Bununla birlikte, bazı hastalarda tenofovir disoproksil fumarat tedavisinin kesilmesine rağmen azalmış kreatinin klerensi tamamen düzelmemiştir. tenofovir disoproksil fumarat tedavisinin kesilmesine rağmen işlevinin eksik olması daha olasıdır (bkz. bölüm 4.4).
didanosin ile etkileşimler
Tenofovir disoproksil fumarat ve didanozinin birlikte uygulanması, didanosine sistemik maruziyette %40-60 artışa neden olduğundan ve didanosine bağlı advers reaksiyon riskinde artışa yol açabileceğinden önerilmez (bkz. bölüm 4.5). Nadiren pankreatit ve bazen ölümcül olabilen laktik asidoz bildirilmiştir.
Lipitler, lipodistrofi ve metabolik değişiklikler
CART, hipertrigliseridemi, hiperkolesterolemi, insülin direnci, hiperglisemi ve hiperlaktatemi gibi metabolik anormallikler ile ilişkilendirilmiştir (bkz. bölüm 4.4).
CART, HIV ile enfekte hastalarda periferik ve fasiyal subkutan yağ kaybı, abdominal ve visseral yağda artış, "meme hipertrofisi ve" dorsoservikal yağ birikimi (manda hörgücü) dahil olmak üzere vücut yağının yeniden dağılımı (lipodistrofi) ile ilişkilendirilmiştir (bkz. 4.4).
Lamivudin ve efavirenz ile kombinasyon halinde tenofovir disoproksil fumarat ile stavudin'i karşılaştıran, önceden antiretrovirallerle tedavi edilmemiş yetişkin hastalarda yürütülen 144 haftalık kontrollü bir çalışmada, tenofovir disoproksil fumarat ile tedavi edilen hastalarda lipodistrofi insidansı, stavudin ile tedavi Tenofovir disoproksil fumarat kolu ayrıca karşılaştırma koluna kıyasla trigliseritlerde ve toplam açlık kolesterolünde önemli ölçüde daha düşük bir ortalama artış gösterdi.
İmmün Reaktivasyon Sendromu
CART başlangıcında ciddi bağışıklık yetmezliği olan HIV ile enfekte hastalarda, asemptomatik veya rezidüel fırsatçı enfeksiyonlara karşı inflamatuar bir reaksiyon ortaya çıkabilir.Otoimmün bozukluklar (Graves hastalığı gibi) de bildirilmiştir, ancak başlama zamanı kaydedilmiştir. daha değişkendir ve bu olaylar tedavinin başlamasından aylar sonra bile ortaya çıkabilir (bkz. bölüm 4.4).
osteonekroz
Osteonekroz vakaları, esas olarak, genel olarak bilinen risk faktörleri olan, ilerlemiş HIV hastalığı olan ve/veya CART'a uzun süre maruz kalan hastalarda rapor edilmiştir. Bu tür vakaların sıklığı bilinmemektedir (bkz. bölüm 4.4).
Pediatrik popülasyon
Advers reaksiyonların değerlendirilmesi, 184 pediyatrik hastada (2 yaşında ve Advers Reaksiyonların Özet Tablosu ve 5.1) yürütülen iki randomize çalışmaya (çalışma GS-US-104-0321 ve GS-US-104-0352) dayanmaktadır.
Pediyatrik hastalarda BMD'de azalmalar bildirilmiştir. HIV-1 ile enfekte olmuş ergenlerde, tenofovir disoproksil fumarat alan deneklerde gözlemlenen BMD Z-skorları, plasebo alan deneklerde görülenlerden daha düşüktü. HIV-1 ile enfekte çocuklarda, tenofovir disoproksil fumarata geçen hastalarda gözlenen BMD Z-skorları, stavudin veya zidovudin tedavisi gören deneklerde gözlenenlerden daha düşüktü (bkz. bölüm 4.4 ve 5.1).
89 hastadan (2 ila
Diğer özel popülasyonlar
Böbrek yetmezliği olan hastalar
Böbrek yetmezliği olan pediyatrik hastalarda tenofovir disoproksil fumarat kullanımı önerilmez (bkz. bölüm 4.2 ve 4.4).
Tedavinin kesilmesinden sonra hepatit alevlenmesi
HBV ile ko-enfekte HIV ile enfekte hastalarda tenofovir disoproksil fumaratın kesilmesinden sonra hepatitin klinik ve laboratuvar kanıtları ortaya çıkmıştır (bkz. bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması
İlacın ruhsatlandırılmasından sonra meydana gelen şüpheli advers reaksiyonların raporlanması, tıbbi ürünün fayda/risk dengesinin sürekli olarak izlenmesine olanak sağladığından önemlidir.Sağlık profesyonellerinden, ulusal raporlama sistemi aracılığıyla herhangi bir şüpheli advers reaksiyonu bildirmeleri istenir:
İtalyan İlaç Ajansı
Web sitesi: http://www.agenziafarmaco.gov.it/it/responsabili
04.9 Doz aşımı
Belirtiler
Doz aşımı durumunda hasta, toksisite belirtileri (bkz. bölüm 4.8 ve 5.3) ve gerekirse olağan destekleyici bakım açısından izlenmelidir.
Yönetmek
Tenofovir hemodiyaliz ile uzaklaştırılabilir; hemodiyaliz için medyan klirens 134 ml / dak. Tenofovirin periton diyalizi ile elimine edilip edilemeyeceği bilinmemektedir.
05.0 FARMAKOLOJİK ÖZELLİKLER
05.1 Farmakodinamik özellikler
Farmakoterapötik grup: Sistemik kullanım için antiviraller; nükleositler ve ters transkriptaz inhibitör nükleotitler, ATC kodu: J05AF07
Etki mekanizması ve farmakodinamik etkiler
Tenofovir disoproksil fumarat, tenofovir disoproksil ön ilacının fumarat tuzudur. Tenofovir disoproksil emilir ve bir monofosfat (nükleotit) nükleozit analoğu olan aktif madde tenofovire dönüştürülür. Tenofovir daha sonra, yapısal olarak eksprese edilen hücresel enzimler tarafından zincirin zorunlu bir sonlandırıcısı olan aktif metabolit tenofovir difosfata dönüştürülür. Tenofovir difosfat, aktive edilmiş periferik kan mononükleer hücrelerinde (PBMC'ler) 10 saatlik ve dinlenme hücrelerinde 50 saatlik hücre içi yarı ömre sahiptir. Tenofovir difosfat, HIV-1 ters transkriptaz ve viral HBV polimerazlarını, doğal substrat deoksiribonükleotit ile doğrudan rekabet içinde ve DNA'nın kendisine dahil edildikten sonra DNA uç zinciri yoluyla bağlanarak inhibe eder. Tenofovir difosfat, hücresel polimerazların zayıf bir inhibitörü müdür? Ve ?. Tenofovir, testlerde mitokondriyal DNA sentezi veya laktik asit üretimi üzerinde herhangi bir etki göstermedi. laboratuvar ortamında, 300 mcmol / l'ye kadar konsantrasyonlarda.
HIV ile ilgili veriler
HIV antivirallerinin in vitro aktivitesi: %50 (EC50) inhibisyonu için gerekli tenofovir konsantrasyonu Vahşi tip HIV-1IIIB laboratuvar testi, lenfoid hücre hatlarında 1-6 µmol/l ve PBMC'lerde primer HIV-1 alt tip B izolatlarına karşı 1,1 µmol/l'dir. Tenofovir ayrıca HIV-1 alt tipleri A, C, D, E, F, G ve O'ya ve birincil monosit / makrofaj hücrelerinde HIVBaL'ye karşı da aktiftir. Tenofovir aktif laboratuvar ortamında MT-4 hücrelerinde 4.9 μmol / l EC50 ile HIV-2'ye karşı.
Direnç: onlar seçildi laboratuvar ortamında ve bazı hastalarda (bkz. Klinik etkinlik ve güvenlik) daha düşük tenofovir duyarlılığı ve ters transkriptazda bir K65R mutasyonu olan HIV-1 suşları. Daha önce antiretroviral tedavi görmüş K65R mutasyonu olan hastalarda tenofovir disoproksil fumarattan kaçınılmalıdır (bkz. bölüm 4.4). Ek olarak, tenofovir ile HIV-1 ters transkriptazında bir K70E ikamesi seçildi ve bu da tenofovire karşı hafifçe azaltılmış duyarlılıkla sonuçlandı.
Daha önce tedavi görmüş hastalarda yapılan klinik çalışmalar, 245 mg tenofovir disoproksil'in (fumarat olarak) nükleozid inhibitörüne dirençli HIV-1 suşlarına karşı anti-HIV aktivitesini tahmin etmiştir.Sonuçlar, Timidin analoglarıyla ilişkili 3 veya daha fazla mutasyonu olan HIV'li hastaların ( M41L veya L210W ters transkriptaz mutasyonunu içeren TAM'ler), 245 mg tenofovir disoproksil (fumarat olarak) ile tedaviye duyarlılığın azaldığını gösterdi.
Klinik etkinlik ve güvenlik
Tenofovir disoproksil fumaratın daha önce tedavi deneyimi olan HIV-1 ile enfekte hastalarda ve önceden tedavi görmemiş hastalarda etkinliğinin gösterilmesi, sırasıyla 48 hafta ve 144 hafta süren klinik çalışmalarda gösterilmiştir.
GS-99-907 çalışmasında, daha önce tedavi deneyimi olan 550 yetişkin hastaya 24 hafta boyunca plasebo veya 245 mg tenofovir disoproksil (fumarat olarak) verildi. Ortalama başlangıç CD4 sayısı 427 hücre/mm3, ortalama başlangıç plazma HIV-1 RNA'sı 3.4 log10 kopya/ml idi (hastaların %78'inde viral yük
24. haftada, log10 (DAVG24) plazma HIV-1 RNA seviyelerinde başlangıca göre zaman ağırlıklı ortalama değişiklik, plasebo ve tenofovir disoproksil 245 mg (fumarat olarak) alan denekler için -0.03 log10 kopya/ml ve -0.61 log10 kopya/ml olmuştur. ) (P
GS-99-903 çalışmasının 144 haftalık, çift kör, kontrollü aşaması, 245 mg tenofovir disoproksil'in (fumarat olarak) etkililiğini ve güvenliğini değerlendirdi e karşı Stavudin, daha önce antiretroviral tedavi görmemiş HIV-1 ile enfekte erişkin hastalarda lamivudin ve efavirenz ile kombinasyon halinde kullanıldığında. Ortalama başlangıç CD4 hücre sayısı 279 hücre/mm3, ortalama başlangıç plazma HIV-1 RNA 4.91 log10 kopya/ml, hastaların %19'unda semptomatik HIV enfeksiyonu ve %18'inde AIDS vardı Hastalar HIV-1 RNA ve başlangıç CD4'e göre sınıflandırıldı Hastaların %43'ünde başlangıç viral yükü > 100.000 kopya / mL ve %39'unda CD4 hücre sayımı vardı
"Tedavi niyeti" analizinden (antiretroviral tedavide (ART) eksik veriler ve geçişler başarısızlık olarak kabul edildi), 48 haftalık tedavide HIV-1 RNA'sı 400 kopya / ml ve 50 kopya / ml'nin altında olan hastaların oranı, tenofovir disoproksil 245 mg kolunda (fumarat olarak) sırasıyla %80 ve %76, stavudin kolunda %84 ve %80 idi.144. haftada, HIV-1 RNA'sı 400 kopyanın altında olan hastaların yüzdesi / mL ve 50 kopya / mL, tenofovir disoproksil 245 mg kolunda (fumarat olarak) sırasıyla %71 ve %68 iken stavudin kolunda sırasıyla %64 ve %63 olmuştur.
Tedavinin 48. haftasında HIV-1 RNA ve CD4 sayımı için başlangıca göre ortalama değişiklik her iki grupta da benzerdi (sırasıyla -3.09 ve -3.09 log10 kopya/ml; +169 ve 167 hücre/mm3). tenofovir disoproksil ile tedavi edilen grup 245 mg (fumarat olarak) ve stavudin ile tedavi edilen grupta). 144 haftalık tedavide, başlangıca göre medyan değişiklik, tenofovir disoproksil gruplarında (fumarat gibi) ve stavudin gruplarında (sırasıyla -3.07 ve -3.03 log10 kopya/ml; +263 ve +283 hücre/mm3) benzer kalmıştır. ). Başlangıç HIV-1 RNA ve CD4 sayımlarından bağımsız olarak 245 mg tenofovir disoproksil (fumarat olarak) ile tedaviye tutarlı yanıt görülmüştür.
K65R mutasyonu, tenofovir disoproksil fumarat grubunda aktif kontrol grubuna göre biraz daha yüksek oranda hastada meydana geldi (%2.7'ye karşı %0.7). Her durumda, efavirenz veya lamivudine direnç, K65R'nin gelişmesinden önce geldi veya onunla aynı zamana denk geldi. Sekiz hasta, tenofovir disoproksil 245 mg kolunda (fumarat olarak) K65R ile HIV ile başvurdu; bunların 7'sinde tedavinin ilk 48 haftasında ve son 96 haftada meydana geldi. 144 haftaya kadar K65R'de başka bir gelişme gözlenmedi Tenofovir disoproksil (fumarat olarak) kolundaki bir hasta ikame geliştirdi. virüs Ne genotipik ne de fenotipik analiz, tenofovire karşı başka direnç kanıtı göstermedi.
"HBV" ile ilgili veriler
Tenofovir disoproksil fumaratın hepatit B virüsüne (HBV) karşı antiviral aktivitesi gösterilmiştir. laboratuvar ortamında ve yetişkinlerde ve ergenlerde klinik ortamda. Viread 245 mg film kaplı tabletler ve Viread 33 mg/g granüller için Kısa Ürün Bilgisine bakın.
Pediatrik popülasyon
GS-US-104-0321 çalışmasında, önceden tedavi deneyimi olan, 12 yaşında ve 48 hafta boyunca optimize edilmiş arka plan rejimi (OBR) olan 87 HIV-1 ile enfekte hasta. Çalışma sınırlamaları nedeniyle, 24. haftada plazma HIV-1 RNA seviyelerine dayalı olarak tenofovir disoproksil fumaratın plaseboya göre bir yararı gösterilmemiştir. Bununla birlikte, " yetişkin verilerinin ekstrapolasyonu ve karşılaştırmalı farmakokinetiğine dayalı olarak adolesan hasta popülasyonu için bir yarar beklenmektedir. veriler (bkz. bölüm 5.2).
Tenofovir disoproksil fumarat veya plasebo ile tedavi edilen hastalarda, ortalama lomber omurga BMD Z-skoru sırasıyla -1.004 ve -0.809 ve ortalama toplam BMD Z-skoru, bazalde sırasıyla -0.866 ve -0.584 idi. 48. haftada (çift kör fazın sonunda) ortalama değişiklikler lomber omurga BMD Z-skoru için -0.215 ve -0.165 ve tenofovir gruplarında toplam BMD Z-skoru için -0.254 ve -0.179 idi. disoproksil fumarat ve plasebo , sırasıyla. Plasebo grubuna kıyasla tenofovir disoproksil fumarat grubunda BMD'deki ortalama artış hızı daha düşüktü. 48. haftada, tenofovir disoproksil fumarat grubundaki altı adolesan ve plasebo grubundaki bir ergen, lomber omurga BMD'sinde önemli bir azalma (>%4 azalma olarak tanımlanır) yaşadı. 96 hafta boyunca tenofovir disoproksil fumarat ile tedavi edilen 28 hastada, BMD Z-skorları lomber omurga için -0.341 ve tüm vücut için -0.458 azaldı.
GS-US-104-0352 çalışmasında, önceden tedavi edilmiş 2 ila zidovudin arasındaki 97 hasta, stavudin veya zidovudin yerine tenofovir disoproksil fumarat (n = 48) veya orijinal rejime (n = 49) 48 hafta devam etmek üzere randomize edilmiştir. 48. haftada, tenofovir disoproksil fumarat tedavi grubundaki hastaların %83'ünde ve stavudin veya zidovudin tedavi grubundaki hastaların %92'sinde HIV-1 RNA konsantrasyonları vardı.
Pediyatrik hastalarda BMD'de azalmalar bildirilmiştir. Tenofovir disoproksil fumarat veya stavudin veya zidovudin ile tedavi edilen hastalarda, ortalama lomber omurga BMD Z-skoru sırasıyla -1.034 ve -0.498 ve başlangıçta ortalama toplam BMD Z-skoru -0.471 ve -0.386 idi. 48. haftada (randomize fazın sonunda) ortalama değişiklikler tenofovir disoproksil fumarat gruplarında lomber omurga BMD Z-skoru için sırasıyla 0.032 ve 0.087 ve toplam BMD Z-skoru için -0.184 ve -0.027 idi ve stavudin veya zidovudin . 48. haftada ortalama lomber omurga kemik kazanımı oranı, tenofovir disoproksil fumarat grubunda ve stavudin veya zidovudin grubunda benzerdi. Stavudin veya zidovudin grubuna kıyasla tenofovir disoproksil fumarat grubunda toplam kemik dokusundaki artış daha küçüktü Tenofovir disoproksil fumarat ile tedavi edilen bir denek ve stavudin veya zidovudin ile tedavi edilen hiçbir denek KMY'de anlamlı (> %4) bir azalma göstermedi. 96 hafta boyunca tenofovir disoproksil fumarat ile tedavi edilen 64 denekte, BMD Z-skorları lomber omurga için -0.012 ve tüm vücut için -0.338 azalmıştır, ağırlık ve boy için ayarlanmıştır.
GS-US-104-0352 çalışmasında, tenofovir disoproksil fumarata maruz kalan 89 pediyatrik hastadan 4'ü, proksimal renal tübülopati ile uyumlu advers reaksiyonlar nedeniyle tedaviyi bırakmıştır (medyan tenofovir disoproksil fumarat maruziyeti: 104 hafta).
Avrupa İlaç Ajansı, HIV ve kronik hepatit B'deki pediyatrik popülasyonun bir veya daha fazla alt kümesinde Viread ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünü ertelemiştir (pediatrik kullanım hakkında bilgi için bkz. bölüm 4.2).
05.2 Farmakokinetik özellikler
Tenofovir disoproksil fumarat, hızla dönüştürülen suda çözünür bir ester ön ilacıdır. canlıda tenofovir ve formaldehit içinde.
Hücrede tenofovir, tenofovir monofosfata ve aktif bileşen olan tenofovir difosfata dönüştürülür.
absorpsiyon
Tenofovir disoproksil fumaratın HIV ile enfekte hastalara oral yoldan verilmesini takiben, bu bileşik hızla emilir ve tenofovire dönüştürülür. HIV ile enfekte hastalara yemekle birlikte tenofovir disoproksil fumaratın çoklu doz uygulaması, ortalama (% CV) tenofovir Cmax, AUC ve Cmin değerleri sırasıyla 326 (%36.6) ng / ml, 3.324 (41) ile sonuçlandı. , 2 %) ng • h/ml ve 64,4 (%39,4) ng/ml. Açlıktan sonraki 1 saat içinde ve yemekle birlikte alındıktan sonraki 2 saat içinde serumda maksimum tenofovir konsantrasyonları gözlenmiştir. biyoyararlanım, tenofovir AUC'de yaklaşık %40'lık bir artışa ve yaklaşık %14'lük bir Cmax'a neden olur. Hastalara yemekten sonra tenofovir disoproksil fumaratın ilk uygulamasını takiben, medyan serum Cmax değeri 213 ila 375 ng/ml arasında değişmiştir Ancak tenofovir disoproksil fumaratın hafif bir yemekle birlikte uygulanması tenofovir farmakokinetiği üzerinde önemli etkilere neden olmamıştır.
Dağıtım
İntravenöz uygulamayı takiben, tenofovirin kararlı durum hacminin yaklaşık 800 ml/kg olduğu tahmin edilmiştir. Tenofovir disoproksil fumaratın oral uygulamasını takiben, tenofovir böbreklerde, karaciğerde ve bağırsak içeriğinde artan konsantrasyonlarla çoğu dokuya dağılır (klinik öncesi çalışmalar). 0,01 ila 25 mcg/ml tenofovir konsantrasyon aralığında, laboratuvar ortamında tenofovir plazma veya serum proteini sırasıyla %0.7 ve %7.2'den azdı.
biyotransformasyon
Çalışmalar laboratuvar ortamında ne tenofovir disoproksil fumarat ne de tenofovirin CYP450 enzimleri için substrat olmadığını belirledi. Ayrıca, gözlemlenenden önemli ölçüde daha yüksek konsantrasyonlarda (yaklaşık 300 kat) canlıda, tenofovir inhibe etmedi laboratuvar ortamında ilaç biyotransformasyonunda yer alan başlıca insan CYP450 izoformlarından birinin aracılık ettiği ilaç metabolizması (CYP3A4, CYP2D6, CYP2C9, CYP2E1 veya CYP1A1 / 2). 100 µmol / l'lik konsantrasyonlarda, tenofovir disoproksil fumarat, CYP1A1 / 2 dışında, CYP1A1 / substrat metabolizmasında hafif (%6) ancak istatistiksel olarak anlamlı bir azalmanın kaydedildiği CYP450 izoformları üzerinde hiçbir etkiye sahip değildi. Bu verilere dayanarak, tenofovir disoproksil fumarat ile CYP450 yoluyla metabolize edilen tıbbi ürünler arasında klinik olarak anlamlı etkileşimler olası değildir.
Eliminasyon
Tenofovir esas olarak böbrek yoluyla hem filtrasyon hem de aktif tübüler taşıma sistemi ile elimine edilir ve dozun yaklaşık %70-80'i intravenöz uygulamayı takiben değişmeden idrarla atılır.Toplam klerensi yaklaşık 230 ml./saat/kg (yaklaşık 300 ml) olarak tahmin edilmiştir. ml/dk) Renal klerens 160 ml/saat/kg (yaklaşık 210 ml/dk) civarında değerlendirilmiştir, bu değer glomerüler filtrasyon hızından daha yüksek bir değerdir.Aktif tübüler sekresyonun tenofovirin eliminasyonunda önemli bir unsur olduğu.Oral uygulamayı takiben tenofovirin terminal yarı ömrü yaklaşık 12-18 saattir.
Çalışmalar, insan organik anyon taşıyıcıları 1 ve 3 yoluyla proksimal tübüler hücrelere giren ve çoklu ilaca dirençli proteinler 4 (MRP 4) yoluyla idrara akan tenofovirin aktif tübüler sekresyon yolunu tanımlamıştır.
Doğrusallık / Doğrusal olmama
75 ila 600 mg doz aralığında, tenofovirin farmakokinetik özellikleri, tenofovir disoproksil fumarat dozundan bağımsızdı ve tekrarlanan dozlar onları etkilemedi.
Seks
Kadınlarda tenofovirin farmakokinetiğine ilişkin mevcut sınırlı veriler, cinsiyete göre önemli bir etki göstermemektedir.
Etnik köken
Çeşitli etnik gruplarda farmakokinetik özel olarak çalışılmamıştır.
Pediatrik popülasyon
Tenofovirin kararlı durum farmakokinetiği 8 adolesan hastada (12 ila 12 yaş arası) analiz edildi.
Tablo 3: Pediatrik Hastalarda Yaş Grubuna Göre Tenofovirin Ortalama (± SD) Farmakokinetik Parametreleri
2 yaşından küçük çocuklarda farmakokinetik çalışmalar henüz yapılmamıştır.
Böbrek yetmezliği
Tenofovir farmakokinetik parametreleri, kreatinin klirensi (CrCl) ile tanımlanan değişen derecelerde böbrek yetmezliği olan HIV ile enfekte olmayan 40 yetişkin hastaya 245 mg tek doz tenofovir disoproksil uygulamasının ardından belirlendi (CrCl> 80 ml/dk olduğunda normal böbrek fonksiyonu; orta CrCl = 50-79 ml/dk ile orta, CrCl = 30-49 ml/dk ile orta ve CrCl = 10-29 ml/dk ile şiddetli). Normal böbrek fonksiyonu olan hastalarla karşılaştırıldığında, CrCl> 80 ml / dak olan hastalarda ortalama konsantrasyon (% CV) 2.185 (% 12) ng • h / ml'den 3.064 (%30) ng • h / ml, 6.009 ( Hafif, orta ve şiddetli böbrek yetmezliği olan hastalarda sırasıyla %42) ng • h/ml ve 15.985 (%45) ng • h/ml.
Kreatinin klerensi periton diyalizi veya diğer diyaliz biçimleri olan hemodiyaliz olmayan yetişkin hastalarda tenofovirin farmakokinetiği çalışılmamıştır.
Böbrek yetmezliği olan pediyatrik hastalarda tenofovir farmakokinetiği çalışılmamıştır. Dozaj önerisinde bulunmak için hiçbir veri mevcut değildir (bkz. bölüm 4.2 ve 4.4).
Karaciğer yetmezliği
Child-Pugh-Turcotte (CPT) sınıflandırmasına göre değişen derecelerde karaciğer yetmezliği olan HIV ile enfekte olmayan yetişkin hastalara tek bir 245 mg tenofovir disoproksil dozu uygulandı. Tenofovir farmakokinetiği, karaciğer yetmezliği olan hastalarda önemli ölçüde değişmemiştir, bu da bu hastalarda herhangi bir doz ayarlaması gerekmediğini düşündürmektedir. Cmax ve AUC0-?'nin ortalaması (% CV)? karşılaştırılabilir normal kişilerde sırasıyla 223 (%34.8) ng/mL ve 2.050 (%50.8) ng • sa/mL, 289 (%46.0) ng/mL ve 2.310 (43, %5) ng • sa/mL idi. orta derecede karaciğer yetmezliği olan hastalarda ve 305 (%24.8) ng/ml ve şiddetli karaciğer yetmezliği olan hastalarda 2.740 (%44.0) ng • h / mL.
Hücre içi farmakokinetik
İnsanlarda, çoğalmayan periferik kan mononükleer hücrelerinde (PBMC'ler), tenofovir difosfatın yarı ömrünün yaklaşık 50 saat olduğu, fitohemagglutinin ile uyarılan PBMC'lerin yarı ömrünün ise yaklaşık 10 saat olduğu bulundu.
05.3 Klinik öncesi güvenlik verileri
klinik olmayan çalışmalar güvenlik farmakolojisi insanlar için özel bir tehlike göstermez Sıçanlarda, köpeklerde ve maymunlarda klinik maruziyet seviyelerine benzer veya daha yüksek seviyelerde ve olası klinik alaka ile gerçekleştirilen tekrarlanan doz toksisite çalışmalarının sonuçları böbrek ve kemik toksisitesini ve azalmış serum fosfat konsantrasyonunu içerir. Kemik toksisitesi, osteomalazi (maymunlarda) ve düşük kemik mineral yoğunluğu (BMD) (sıçanlarda ve köpeklerde) olarak teşhis edildi. Sıçanlarda ve genç yetişkin köpeklerde, pediyatrik veya yetişkin hastaların maruziyetinin ≥ 5 katı maruziyetlerde kemik toksisitesi meydana geldi; enfekte genç maymunlarda, subkutan uygulamadan sonra (≥ 40 kat 1 "hasta maruziyeti) çok yüksek maruziyetlerde kemik toksisitesi meydana geldi. Sıçanlarda ve maymunlarda yapılan çalışmalardan elde edilen sonuçlar, BMD'de potansiyel ikincil azalma ile birlikte bağırsak fosfat emiliminde maddeye bağlı bir azalma olduğunu göstermektedir.
Genotoksisite çalışmaları pozitif test sonuçları verdi laboratuvar ortamında fare lenfomasında Ames testinde kullanılan suşlardan birinde şüpheli sonuçlar ve birincil sıçan hepatositlerinde USD testinde zayıf pozitif sonuçlar. Bununla birlikte, bir fare kemik iliği mikronükleus testinde mutasyonların indüklenmesinde negatifti. canlıda.
Sıçanlarda ve farelerde yapılan oral karsinojenisite çalışmaları, farelerde son derece yüksek bir dozda düşük bir duodenal tümör insidansı göstermiştir. Bu tümörlerin insanlarla ilgili olması olası değildir.
Sıçanlarda ve tavşanlarda yapılan üreme toksisitesi çalışmaları, çiftleşme, doğurganlık, hamilelik veya fetal parametreler üzerinde hiçbir etki göstermedi. Bununla birlikte, perinatal ve postnatal toksisite çalışmalarında, tenofovir disoproksil fumarat, maternal toksik dozlarda canlılığı ve yavru ağırlığını azaltmıştır.
Aktif madde tenofovir disoproksil fumarat ve ana dönüşüm ürünleri çevrede varlığını sürdürmektedir.
06.0 FARMASÖTİK BİLGİLER
06.1 Yardımcı maddeler
tabletin çekirdeği
kroskarmeloz sodyum
laktoz monohidrat
Magnezyum stearat (E572)
Mikrokristalin selüloz (E460)
önceden jelatinleştirilmiş nişasta
kaplama filmi
Gliserol triasetat (E1518)
Hipromelloz (E464)
laktoz monohidrat
Titanyum dioksit (E171)
06.2 Uyumsuzluk
İlgili değil.
06.3 Geçerlilik süresi
2 yıl.
06.4 Depolama için özel önlemler
Bu ilaç herhangi bir özel saklama koşulu gerektirmez.
06.5 İç ambalajın yapısı ve paketin içeriği
Çocuklara dayanıklı polipropilen kapaklı, 30 film kaplı tablet ve kurutucu olarak silika jel içeren yüksek yoğunluklu polietilen (HDPE) şişe.
Aşağıdaki ambalaj boyutları mevcuttur: 1 şişe 30 film kaplı tablet içeren dış karton ve 90 (3 şişe 30'luk) film kaplı tablet içeren dış karton. Tüm paket boyutları pazarlanmayabilir.
06.6 Kullanım ve kullanım talimatları
Kullanılmayan ilaçlar ve bu ilaçtan elde edilen atıklar yerel yönetmeliklere uygun olarak atılmalıdır.
07.0 PAZARLAMA YETKİ SAHİBİ
Gilead Sciences Uluslararası Sınırlı
Cambridge
CB21 6GT
Birleşik Krallık
08.0 PAZARLAMA YETKİ NUMARASI
AB / 1/01/200/006
AB / 1/01/200/007
035565062
035565074
09.0 İLK İZİN VEYA İZİNİN YENİLENMESİ TARİHİ
İlk izin tarihi: 5 Şubat 2002
En son yenileme tarihi: 14 Aralık 2011
10.0 METİN REVİZYON TARİHİ
05/2015